Содержание
Ионы металлов в водном растворе — Metal ions in aqueous solution
Ион металла в водном растворе или аква — иона представляет собой катион , растворенного в воде , из химической формулы [М (Н 2 О) п ] г + . Число сольватации , п , определяется с помощью различных экспериментальных методов является 4 для Li + и Be 2+ и 6 для элементов в периодах 3 и 4 таблицы Менделеева . Акваионы лантаноидов и актинидов имеют сольватное число 8 или 9. Прочность связей между ионом металла и молекулами воды в первичной сольватной оболочке увеличивается с увеличением электрического заряда z на ионе металла и уменьшается с увеличением его ионного радиуса , r , увеличивается. Ионы воды подвержены гидролизу. Логарифм первой константы гидролиза пропорционален z 2 / r для большинства акваионов.
Акваион связан посредством водородных связей с другими молекулами воды во вторичной сольватной оболочке. Молекулы воды в первой гидратной оболочке обмениваются с молекулами во второй сольватной оболочке и молекулами в объеме жидкости. Время пребывания молекулы в первой оболочке варьируется среди химических элементов от примерно 100 пикосекунд до более 200 лет. Ионы воды занимают важное место в электрохимии .
СОДЕРЖАНИЕ
Введение в акваионы металлов
| ЧАС | Он | ||||||||||||||||||||||||||||||
| Ли | Быть | B | C | N | О | F | Ne | ||||||||||||||||||||||||
| Na | Mg | Al | Si | п | S | Cl | Ar | ||||||||||||||||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge * | В виде | Se | Br | Kr | ||||||||||||||
| Руб. | Sr | Y | Zr | Nb | Пн | Tc | RU | Rh | Pd | Ag | Компакт диск | В | Sn | Sb * | Te | я | Xe | ||||||||||||||
| CS | Ба | Ла | Ce | Pr | Nd | Вечера | См | Европа | Б-г | Tb | Dy | Хо | Э | Тм | Yb | Лу | Hf | Та | W | Re | Операционные системы | Ir | Pt | Au | Hg | Tl | Pb | Би | По * | В | Rn |
| Пт * | Ра * | Ac | Чт | Па | U | Np | Пу | Являюсь | См | Bk | Cf | Es * | Fm * | Мкр * | Нет* | Lr * |
* Нет экспериментальной информации о структурах акваионов.
Большинство химических элементов — металлические . Соединения металлических элементов обычно образуют простые акваионы с формулой [M (H 2 O) n ] z + в низких степенях окисления . При более высоких степенях окисления простые акваионы диссоциируют, теряя ионы водорода, с образованием комплексов, содержащих как молекулы воды, так и ионы гидроксида или оксида, такие как частицы ванадия (IV) [VO (H 2 O) 5 ] 2+ . В высших степенях окисления только оксианионы , такие как перманганат- ион (VII), MnO —
4 , известны. Некоторые элементы, такие как олово и сурьма , явно являются металлами, но образуют только ковалентные соединения в высших степенях окисления. В трансактинидах были оставлены из — за отсутствие экспериментальных данных.
Говорят, что в водном растворе молекулы воды, непосредственно связанные с ионом металла, принадлежат к первой координационной сфере , также известной как первая или первичная сольватная оболочка. Связь между молекулой воды и ионом металла представляет собой дативную ковалентную связь , при этом атом кислорода передает связи оба электрона. Каждая координированная молекула воды может быть присоединена водородными связями к другим молекулам воды. Считается, что последние находятся во второй координационной сфере. Вторая координационная сфера не является четко определенным объектом для ионов с зарядом 1 или 2. В разбавленных растворах она сливается со структурой воды, в которой существует нерегулярная сеть водородных связей между молекулами воды. В случае триположительных ионов высокий заряд катиона поляризует молекулы воды в первой сольватной оболочке до такой степени, что они образуют достаточно прочные водородные связи с молекулами во второй оболочке, чтобы сформировать более стабильную единицу.
Прочность связи металл-кислород можно оценить по-разному. Энтальпия гидратации, хотя и основанная косвенно на экспериментальных измерениях, является наиболее надежным показателем. Шкала значений основана на произвольно выбранном нуле, но это не влияет на разницу между значениями для двух металлов. Другие меры включают частоту колебаний M – O и длину связи M – O. Прочность связи МО имеет тенденцию увеличиваться с ростом заряда и уменьшаться с увеличением размера иона металла. Фактически существует очень хорошая линейная корреляция между энтальпией гидратации и отношением заряда к ионному радиусу z 2 / r. Для ионов в растворе «эффективный ионный радиус Шеннона» — это наиболее часто используемая мера.
Молекулы воды в первой и второй сольватных оболочках могут меняться местами. Скорость обмена сильно различается в зависимости от металла и степени его окисления. Акваионы металлов всегда сопровождаются в растворе сольватированными анионами, но о сольватации анионов известно гораздо меньше, чем о сольватации катионов.
Пониманию природы акваионов помогает информация о природе сольватированных катионов в смешанных растворителях и неводных растворителях , таких как жидкий аммиак , метанол , диметилформамид и диметилсульфоксид, чтобы упомянуть некоторые из них.
Встречаемость в природе
Аква-ионы присутствуют в большинстве природных вод. Na + , K + , Mg 2+ и Ca 2+ являются основными составляющими морской воды .
| Ион | Na + | K + | Mg 2+ | Ca 2+ |
|---|---|---|---|---|
| Концентрация (моль кг −1 ) |
0,469 | 0,0102 | 0,0528 | 0,0103 |
Многие другие акваионы присутствуют в морской воде в концентрациях от ppm до ppt . Концентрации натрия, калия, магния и кальция в крови аналогичны концентрации в морской воде. В крови также ниже концентрация основных элементов, таких как железо и цинк. Спортивный напиток предназначен для изотонических , а также содержит минералы , которые теряются в поте .
Ионы магния и кальция являются обычными составляющими бытовой воды и ответственны за постоянную и временную жесткость соответственно. Их часто можно найти в минеральной воде .
Экспериментальные методы
Информация, полученная о природе ионов в растворе, зависит от типа используемого экспериментального метода. Некоторые методы выявляют свойства катиона напрямую, другие выявляют свойства, которые зависят как от катиона, так и от аниона. Некоторые методы предоставляют информацию статического характера, своего рода снимок средних свойств, другие предоставляют информацию о динамике решения.
Ядерный магнитный резонанс (ЯМР)
Ионы, для которых скорость водообмена низкая по шкале времени ЯМР, дают отдельные пики для молекул в первой сольватной оболочке и для других молекул воды. Число сольватации получается как отношение площадей пиков. Здесь это относится к количеству молекул воды в первой сольватной оболочке. Молекулы во второй сольватной оболочке быстро обмениваются с молекулами растворителя, вызывая небольшое изменение значения химического сдвига некоординированных молекул воды по сравнению с самой водой. Основным недостатком этого метода является то, что он требует достаточно концентрированных растворов, что связано с риском образования ионной пары с анионом.
| Ион | Быть 2+ | Мг 2+ | Al 3+ | Ga 3+ | Через 3+ | Fe 2+ | Co 2+ | Ni 2+ | Zn 2+ | Чт 4+ |
|---|---|---|---|---|---|---|---|---|---|---|
| Номер | 4 | 6 | 6 | 6 | 6 | 6 | 6 | 6 | 6 | 9 |
| Ядро | 1 Н 17 О | 1 ч | 1 ч | 1 Н 17 О | 1 ч | 17 O | 1 ч | 1 Н 17 О | 1 ч | 1 ч |
Рентгеновская дифракция (XRD)
Раствор, содержащий акваион, не имеет дальнего порядка, который присутствовал бы в кристалле, содержащем тот же ион, но есть ближний порядок. Дифракция рентгеновских лучей на растворах дает функцию радиального распределения, из которой можно определить координационное число иона металла и расстояние металл-кислород. С помощью акваионов с большим зарядом можно получить некоторую информацию о второй сольватной оболочке.
Этот метод требует использования относительно концентрированных растворов. Рентгеновские лучи рассеиваются электронами, поэтому рассеивающая способность увеличивается с атомным номером. Это делает атомы водорода почти невидимыми для рассеяния рентгеновских лучей.
Рассеяние рентгеновских лучей под большим углом было использовано для характеристики второй сольватационной оболочки с трехвалентными ионами, такими как Cr 3+ и Rh 3+ . Вторая гидратная оболочка Cr 3+ имеет 13 ± 1 молекула на среднем расстоянии 402 ± 20 пм . Это означает, что каждая молекула в первой гидратной оболочке связана водородными связями с двумя молекулами во второй оболочке.
Нейтронная дифракция
Дифракция на нейтронах также дает функцию радиального распределения . В отличие от дифракции рентгеновских лучей, нейтроны рассеиваются ядрами, и нет никакой связи с атомным номером. Действительно, можно использовать тот факт, что разные изотопы одного и того же элемента могут иметь сильно различающуюся рассеивающую способность. В классическом эксперименте измерения проводились на четырех растворах хлорида никеля с использованием комбинаций изотопов 58 Ni, 60 Ni, 35 Cl и 37 Cl, чтобы получить очень подробную картину сольватации катионов и анионов. Данные для ряда солей металлов показывают некоторую зависимость от концентрации соли.
| Поваренная соль | LiCl | CaCl 2 | NiCl 2 | |||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Моляльность соли | 27,77 | 9,95 | 3,57 | 4,49 | 2,80 | 1.0 | 3,05 | 0,85 | 0,46 | 0,086 |
| Число гидратации катионов † | 2,3 (2) | 3,0 (5) | 5,5 (3) | 6,4 (3) | 7,2 (2) | 10,0 (6) | 5,8 (2) | 6,6 (5) | 6,8 (8) | 6,8 (8) |
| θ / град ‡ | 75 (5) | 52 (5) | 40 (5) | 34 (9) | 34 (9) | 38 (9) | 42 (8) | 27 (10) | 17 (10) | 0 (20) |
| Поваренная соль | Ni (ClO 4 ) 2 | Cu (ClO 4 ) 2 | Fe (NO 3 ) 3 | NdCl 3 | DyCl 3 |
|---|---|---|---|---|---|
| Моляльность соли | 3,80 | 2,00 | 2.0 | 2,85 | 2.38 |
| Число гидратации катионов † | 5,8 (2) | 4,9 (3) | 5,0 (2) | 8,5 (2) | 7,4 (5) |
| θ / град ‡ | 42 (8) | 38 (6) | 22 (4) | 24 (4) | 17 (3) |
† Цифры в скобках представляют собой стандартные отклонения последней значащей цифры значения. ‡ угол между связью M-OH 2 и плоскостью молекулы воды.
Большинство этих данных относятся к концентрированным растворам, в которых очень мало молекул воды, которые не находятся в сферах первичной гидратации катиона или аниона, что может объяснить некоторые вариации сольватационного числа с концентрацией, даже если нет контактного иона. спаривание. Угол θ дает угол наклона молекул воды относительно плоскости в акваионе. На этот угол влияют водородные связи, образующиеся между молекулами воды в первичной и вторичной сольватных оболочках.
Измеренное сольватационное число представляет собой усредненное по времени значение для раствора в целом. Когда измеренное число первичной сольватации является дробным, два или более частиц с целыми числами сольватации находятся в равновесии друг с другом. Это также относится к числам сольватации, которые являются целыми числами в пределах экспериментальной ошибки. Например, сольватационное число 5,5 для раствора хлорида лития можно интерпретировать как результат присутствия двух разных акваионов с равными концентрациями.
Другая возможность состоит в том, что существует взаимодействие между сольватированным катионом и анионом, образуя ионную пару . Это особенно актуально при измерениях концентрированных солевых растворов. Например, сольватационное число 3 для раствора хлорида лития можно интерпретировать как результат равновесия
лежащий целиком в пользу ионной пары.
Колебательные спектры
Инфракрасные спектры и спектры комбинационного рассеяния могут быть использованы для измерения частоты растяжения МО в акваионах металлов. Рамановская спектроскопия особенно полезна, потому что спектр комбинационного рассеяния воды слаб, тогда как инфракрасный спектр воды интенсивен. Интерпретация частот колебаний несколько усложняется наличием в октаэдрических и тетраэдрических ионах двух колебаний: симметричного, измеренного в спектре комбинационного рассеяния, и антисимметричного, измеренного в инфракрасном спектре.
| ион металла | Быть 2+ | Мг 2+ | Mn 2+ | Fe 2+ | Ni 2+ | Cu 2+ | Zn 2+ | Hg 2+ | Al 3+ | Ga 3+ | Через 3+ |
|---|---|---|---|---|---|---|---|---|---|---|---|
| волновое число / см −1 | 530-543 | 360-365 | 395 | 389 | 405 | 440 | 385-400 | 380 | 520-526 | 475 | 400 |
Хотя связь между частотой колебаний и силовой постоянной непроста, общий вывод, который можно сделать из этих данных, заключается в том, что прочность связи МО увеличивается с увеличением заряда иона и уменьшением размера ионов. Частоту растяжения МО акваиона в растворе можно сравнить с его аналогом в кристалле известной структуры. Если частоты очень похожи, можно сделать вывод, что координационное число иона металла в растворе такое же, как и в соединении в твердом состоянии.
Динамические методы
Такие данные, как проводимость , электрическая подвижность и диффузия, относятся к движению ионов в растворе. Когда ион движется через раствор, он имеет тенденцию уносить с собой как первую, так и вторую сольватные оболочки. Следовательно, числа сольватации, измеренные по динамическим свойствам, обычно намного выше, чем числа, полученные по статическим свойствам.
| Ли + | Na + | CS + | Мг 2+ | Ca 2+ | Ba 2+ | Zn 2+ | Cr 3+ | Al 3+ | |
|---|---|---|---|---|---|---|---|---|---|
| Ионный транспортный номер | 13–22 | 7-13 | 4 | 12–14 | 8–12 | 3-5 | 10-13 | ||
| Ионная подвижность | 3–21 | 2-10 | 10-13 | 7-11 | 5-9 | 10-13 | |||
| Диффузия | 5 | 3 | 1 | 9 | 9 | 8 | 11 | 17 | 13 |
Сольватационные числа и структуры
Водород
Водород не является металлом, но, как и они, он имеет тенденцию терять свой валентный электрон в химических реакциях, образуя катион H + . В водном растворе он немедленно присоединяется к молекуле воды, образуя разновидности, обычно обозначаемые как H 3 O + (иногда свободно обозначаемые как H + ). При такой гидратации образуются катионы, которые по существу можно рассматривать как [H (OH 2 ) n ] + .
Сольватация H + в воде полностью не охарактеризована, и было предложено множество различных структур. Две хорошо известные структуры — это катион Цунделя и собственный катион . В сольватационной структуре Эйгена ион гидроксония находится в центре H
9 О +
4 комплекс, в котором гидроксоний прочно связан водородными связями с тремя соседними молекулами воды. В Zundel H
5 О +
2 В комплексе протон поровну разделен на две молекулы воды симметричной водородной связью .
Щелочные металлы
Для акваионов лития найдены сольватационные числа 3–6 . Число сольватации менее 4 может быть результатом образования контактных ионных пар . Более высокие числа сольватации можно интерпретировать с точки зрения молекул воды, которые приближаются к [Li (H 2 O) 4 ] + через грань тетраэдра, хотя молекулярно-динамическое моделирование может указывать на существование октаэдрического акваиона. Скорее всего, в первичной сольватной сфере иона натрия находится шесть молекул воды . Калий и рубидий , скорее всего, имеют 8-координатную квадратную антипризматику, а цезий — 12-координатную.
Щелочноземельные металлы
| [Be (H 2 O) 4 ] 2+ | [Mg (H 2 O) 6 ] 2+ | Ca 2+ (водн.) | Sr 2+ (водн.) | Ba 2+ (водн.) | |
|---|---|---|---|---|---|
| МО расстояние (pm) | 167 | 209 | 242 § | 263 § | 281 § |
| Δ ЧАС ⊖ < displaystyle Delta H ^ < ominus>> сольватация (кДж моль -1 ) | 2494 | 1921 г. | 1577 | 1443 | 1305 |
§ Значения, экстраполированные из данных для твердотельных кристаллических структур.
Бериллий катион [Be (H 2 O) 4 ] 2+ имеет очень хорошо определенную оболочку первичной сольватации с тетраэдрическим ВеО 4 сердечником. Для магния [Mg (H 2 O) 6 ] 2+ также является хорошо охарактеризованным веществом с октаэдрическим ядром MgO 6 . С кальцием дело обстоит сложнее. Данные нейтронографии дали сольватационное число для хлорида кальция, CaCl 2 , которое сильно зависит от концентрации: 10,0 ± 0,6 при 1 моль · дм −3 , снижаясь до 6,4 ± 0,3 при 2,8 моль · дм -3 . Энтальпия сольватации уменьшается с увеличением ионного радиуса. Известны различные твердые гидраты с 8-координацией в квадратной антипризме и додекаэдрической геометрии. В воде кальций (II), стронций (II) и барий (II) имеют 8-координатный квадрат антипризматики. Расчеты показывают, что число гидратации радия (II) составляет 6–9, хотя экспериментально оно не наблюдалось.
Металлы 3 группы, лантаноиды и актиниды
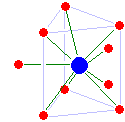
Иттрий (III) — антипризматический квадрат с 8 координатами. Ионы трехвалентного лантаноида неуклонно уменьшаются в размере от лантана до лютеция , эффект, известный как сокращение лантаноидов . От лантана до диспрозия координационное число поддерживается на уровне 9 с тригонально-призматической структурой с треугольными чашечками, хотя, начиная с самария, молекулы закрывающей воды больше не связаны одинаково сильно. Затем возникает дефицит воды для гольмия через лютеций со средним координационным числом, снижающимся до 8,2 для лютеция (III). Скандий (III) аналогичен со средним координационным числом 8,0. Конфигурация сохраняется, несмотря на небольшой размер катионов и дефицит воды, вероятно, из-за сильной водородной связи. Церий (IV) — восьмикоординатный квадрат антипризматический; европий (II) имеет координационное число 8, но его структура неизвестна.
Считается, что сольватационные числа 9 или более применимы к ионам актинида в степенях окисления +3 и +4. Это известно только для актиния (III), тория (IV), урана (IV), нептуния (IV), плутония (III) и (IV), америция (III) и кюрия (III). Торий (IV), уран (IV), нептуний (IV) и плутоний (IV), вероятно, имеют трехглавую треугольную призму. На сегодняшний день исследования координационного числа и / или структуры распространяются только на калифорний . Ожидается, что координационные числа будут уменьшаться для поздних актинидов, как и для поздних лантаноидов.
Металлы 4-12 группы


Ионы этих металлов в степенях окисления +2 и +3 имеют сольватационное число 6. Все они имеют правильную октаэдрическую структуру, за исключением акваионов хрома (II) и меди (II), которые подвержены искажению Яна-Теллера . В случае меди два аксиальных расстояния Cu-O составляют 238 пм, тогда как четыре экваториальных расстояния Cu-O составляют 195 пм в твердом состоянии. Однако неясно, имеет ли Cu 2+ сольватационное число 5 или 6 в водном растворе, с противоречивыми экспериментальными сообщениями. Серебро (I), вероятно, является четырехкоординатным, [Ag (H 2 O) 4 ] + .
Сольватационное число 6 с октаэдрической структурой хорошо установлено для цинка (II) и кадмия (II) в разбавленных растворах. В концентрированных растворах ион Zn 2+ может принимать четырехкоординатную тетраэдрическую структуру, но доказательства неубедительны из-за возможности образования пар и / или гидролиза ионов. Сольватационное число ртути (II), скорее всего, равно 6.
Бис-водная структура иона ртути (I), [(H 2 O) -Hg-Hg- (OH 2 ] + , обнаруженная в твердых соединениях, также обнаруживается в растворе. Металлическая связь представляет собой разновидность молибдена (II), формулируемую как [(H 2 O) 4 Mo≣Mo (H 2 O) 4 ] 4+ . Каждый молибден окружен четырьмя молекулами воды в плоско-квадратном расположении с аналогичной структурой. с известной структурой хлорокомплекса [Mo 2 Cl 8 ] 4- , однако не исключено присутствие пятой молекулы воды в аксиальном положении.
Есть несколько двухвалентных и трехвалентных акваионов переходных металлов во втором и третьем переходных рядах: рутений (II) и (III), осмий (II), родий (III) и иридий (III), все октаэдрические. Молибден (III) сильно гидролизуется в водном растворе, а молибден (II) димеризуется. Первоначально считалось, что акваионы палладия (II) и платины (II) имеют плоскую квадратную форму, но на самом деле они имеют сильно вытянутую тетрагональную форму октаэдра. Серебро (I) образует искаженный тетраэдр, золото (I) линейный, а золото (III) искаженный октаэдр. Медь (I) экстраполируется как тетраэдрическая. Для низкоординированных металлов с сильными ковалентными тенденциями искажение возникает из-за эффекта Яна-Теллера второго порядка. Однако при степени окисления 4 единственными негидролизованными частицами являются квадратный антипризматический цирконий (IV), [Zr (H 2 O) 8 ] 4+ и гафний (IV), [Hf (H 2 O) 8 ] 4+ , и даже они чрезвычайно склонны к гидролизу: такой катион циркония образуется только в разбавленных растворах Zr IV в сильной кислоте. На практике встречающиеся катионные частицы циркония и гафния являются полиядерными.
Металлы 13-17 группы
Акваион алюминия (III) [Al (H 2 O) 6 ] 3+ очень хорошо охарактеризован как в растворе, так и в твердом состоянии. Ядро AlO 6 имеет октаэдрическую симметрию, точечную группу O h . Акваионы галлия (III), индия (III) и таллия (III) также имеют сольватационное число 6. Акваион таллия (I) часто считается 6-координатным, но это предположение не основано на убедительные экспериментальные доказательства. Радиус Шеннона Tl + в 150 пм не сильно отличается от радиуса K + в 138 пм, так что некоторое сходство между химией Tl + и K + ожидается и наблюдается. По-видимому, существует два разных расстояния связи Tl – O, но координационное число и структура еще не определены экспериментально.
Олово (II) и свинец (II) имеют 3-х и 6-ти координатную полукорпусную направленность соответственно. Для олова (II) первая координационная сфера рассчитана так, чтобы разделиться на две полусферы на разных расстояниях от иона. На практике эти катионы имеют тенденцию быть полиядерными. Висмут (III) представляет собой 8-координатную искаженную квадратную антипризматическую форму.
Акваионы элементов вблизи разделительной линии металл – неметалл очень легко гидролизуются и не могут быть легко изучены экспериментально. Есть некоторые свидетельства того, что акваионы германия (II) могут образовываться в хлорнокислой среде. Однако он легко окисляется до германия (IV). Акваионы сурьмы (III) могут также присутствовать в разбавленных растворах сурьмы (III) в концентрированных кислотах, но прямых доказательств этого нет. Квантово-механические расчеты показывают, что существуют акваионы германия (II) и сурьмы (III): они демонстрируют крайнее искажение первой координационной сферы из-за высокой плотности заряда и стереохимически активных неподеленных пар. Для германия (II) первая оболочка обычно имеет сольватационное число 6, но числа 4–7 также возможны, и оболочка разделяется на две с разными расстояниями от центрального Ge 2+ . Подобные исследования для сурьмы (III) показывают сольватационное число 8, при этом первая координационная сфера расщепляется на две гидратные полусферы с 4 молекулами воды в каждой. Расчеты для полония (IV) показывают сольватационное число от 8 до 9.
Мышьяк (III) и астат (I), по-видимому, не образуют аквакатионы: рассчитано, что мышьяк (III) образует только гидролизованные частицы, а данные электромиграции показывают, что астат (I) образует протонированную гипоастатозную кислоту [H 2 OAt] + в кислой среде. растворы (демонстрируя аналогию с йодом). По расчетам, стабильные катионные формы мышьяка (III) в воде составляют [As (OH) 2 ] + . В степени окисления +4 для германия (IV), олова (IV) и свинца (IV) ожидаются только гидролизованные частицы. Катионный теллур (IV) представляет собой [Te (OH) 3 ] + .
Хотя на структуры таллия (I), германия (II), олова (II), свинца (II) и сурьмы (III) влияют неподеленные пары, это не так для висмута (III).
Оксо-аква-катионы
Некоторые элементы в степени окисления выше 3 образуют стабильные, водные оксо-ионы. Хорошо известными примерами являются ионы ванадила (IV) и уранила (VI). Их можно рассматривать как особо стабильные продукты гидролиза в гипотетической реакции, такой как
Ванадия имеет искаженное октаэдрическое окружение ( точечная группа С 4V ) одного иона оксида и 5 молекул воды. Титанил, TiO 2+ , имеет аналогичную структуру. Считается, что ванадий (V) существует в виде диоксо-иона [VO 2 (H 2 O) 4 ] + при pH менее 2, но доказательства наличия этого иона зависят от образования комплексов, таких как оксалатные комплексы, которые были показано голосование +
2 единица с цис- связями -VO в твердом состоянии. Хрома (IV) , ион [CrO (Н 2 О) 5 ] 2+ , подобный ион ванадия был предложен на основе косвенных доказательств.
Ион уранила, UO 2+
2 , имеет транс- структуру. Акваион UO 2+
2 (aq) было предположено, на основе косвенных доказательств, что имеет пять молекул воды в плоскости, перпендикулярной оси OUO в структуре пентагональной бипирамиды , точечная группа D 5h . Однако также возможно, что в экваториальной плоскости находится 6 молекул воды, гексагональная бипирамида , точечная группа D 6h , так как известно множество комплексов с такой структурой. Состояние сольватации иона плутонила PuO 2+
2 , не известно.
Термодинамика
Основная цель термодинамики в этом контексте — получить оценки одноионных термодинамических величин, таких как энтальпия гидратации и энтропия гидратации . Эти количества относятся к реакции
M z + (газ) + растворитель → M z + (в растворе)
Энтальпию этой реакции нельзя измерить напрямую, потому что во всех измерениях используются солевые растворы, содержащие как катион, так и анион. Большинство экспериментальных измерений относятся к теплу, выделяющемуся при растворении соли в воде, которое дает сумму энтальпий сольватации катионов и анионов. Затем, рассматривая данные для разных анионов с одним и тем же катионом и разных катионов с одним и тем же анионом, получают значения для одного иона относительно произвольного нуля.
14 различных типов металлов

Термин «металл» происходит от греческого слова «metalléuō», что означает выкапываю или добываю из земли. Наша планета содержит много металла. На самом деле из 118 элементов периодической системы порядка 95 являются металлами.
Это число не является точным, потому что граница между металлами и неметаллами довольно расплывчата: нет стандартного определения металлоида, как нет и полного согласия относительно элементов, соответствующим образом классифицированных как таковые.
Сегодня мы используем различные виды металлов, даже не замечая их. Начиная с зажимов в сантехнике и заканчивая устройством, которое вы используете для чтения этой статьи, все они сделаны из определенных металлов. Фактически, некоторые металлические элементы необходимы для биологических функций, таких как приток кислорода и передача нервных импульсов. Некоторые из них также широко используются в медицине в виде антацидов.
Все металлы в периодической таблице можно классифицировать по их химическим или физическим свойствам. Ниже мы перечислили некоторые различные типы металлов вместе с их реальным применением.
Классификация по физическим свойствам
14. Легкие металлы

Сплав титана 6AL-4V
Примеры: Алюминий, титан, магний
Легкие металлы имеют относительно низкую плотность. Формального определения или критериев для идентификации этих металлов нет, но твердые элементы с плотностью ниже 5 г/см³ обычно считаются легкими металлами.
Металлургия легких металлов была впервые развита в середине 19 века. Хотя большинство из них происходит естественным путем, значительная их часть образуется при электротермии и электролизе плавленых солей.
Их сплавы широко используются в авиационной промышленности благодаря их низкой плотности и достаточным механическим свойствам. Например, сплав титана 6AL-4V составляет почти 50 процентов всех сплавов, используемых в авиастроении. Он используется для изготовления роторов, лопастей компрессоров, мотогондол, компонентов гидравлических систем.
13. Тяжелые металлы

Окисленные свинцовые конкреции и кубик размером 1 см3
Примеры: железо, медь, кобальт, галлий, олово, золото, платина.
Тяжелые металлы — это элементы с относительно высокой плотностью (обычно более 5 г/см³) и атомным весом. Они, как правило, менее реактивны и содержат гораздо меньше растворимых сульфидов и гидроксидов, чем более легкие металлы.
Эти металлы редки в земной коре, но они присутствуют в различных аспектах современной жизни. Они используются в солнечных батареях, сотовых телефонах, транспортных средствах, антисептиках и ускорителях частиц.
Тяжелые металлы часто смешиваются в окружающей среде из-за промышленной деятельности, ухудшая качество почвы, воды и воздуха, а затем вызывая проблемы со здоровьем у животных и растений. Выбросы транспортных средств, горнодобывающие и промышленные отходы, удобрения, свинцово-кислотные батареи и микропластики, плавающие в океанах, являются одними из наиболее распространенных источников тяжелых металлов в этом контексте.
12. Белый металл

Подшипники из белого металла
Примеры: Обычно изготавливается из олова, свинца, висмута, сурьмы, кадмия, цинка.
Белые металлы — это различные светлые сплавы, используемые в качестве основы для украшений или изделий из серебра. Например, многие сплавы на основе олова или свинца используются в ювелирных изделиях и подшипниках.
Белый металлический сплав изготавливается путем объединения определенных металлов в фиксированных пропорциях в соответствии с требованиями конечного продукта. Основной металл для ювелирных изделий, например, формуется, охлаждается, экстрагируется, а затем полируется, чтобы придать ему точную форму и блестящий вид.
Они также используются для изготовления тяжелых подшипников общего назначения, подшипников внутреннего сгорания среднего размера и электрических машин.
11. Хрупкий металл

Хрупкое разрушение чугуна
Примеры: сплавы углеродистой стали, чугуна и инструментальной стали.
Металл считается хрупким, если он твердый, но не может противостоять ударам или вибрации под нагрузкой. Такие металлы под воздействием напряжения ломаются без заметной пластической деформации. Они имеют низкую прочность на разрыв и часто издают щелкающий звук при поломке.
Многие стальные сплавы становятся хрупкими при низких температурах, в зависимости от их обработки и состава. Чугун, например, твердый, но хрупкий из-за высокого содержания углерода. Напротив, керамика и стекло гораздо более хрупки, чем металлы, из-за их ионных связей.
Галлий, висмут, хром, марганец и бериллий также хрупки. Они часто используются в различных гражданских и военных целях, связанных с высокими деформационными нагрузками. Чугун, устойчивый к повреждениям в результате окисления, используется в машинах, трубах и деталях автомобильной промышленности, таких как корпуса коробок передач и головки цилиндров.
10. Тугоплавкий металл
Микроскопическое изображение вольфрамовой нити в лампе накаливания
Примеры: молибден, вольфрам, тантал, рений, ниобий.
Тугоплавкие металлы имеют чрезвычайно высокие температуры плавления (более 2000 °С) и устойчивы к износу, деформации и коррозии. Они являются хорошими проводниками тепла и электричества и имеют высокую плотность.
Другой ключевой характеристикой является их термостойкость: они не расширяются и не растрескиваются при многократном нагревании и охлаждении. Однако они могут деформироваться при высоких нагрузках и окисляться при высоких температурах.
Благодаря своей прочности и твердости они идеально подходят для сверления и резки. Карбиды и сплавы тугоплавких металлов используются почти во всех отраслях промышленности, включая горнодобывающую, автомобильную, аэрокосмическую, химическую и ядерную.
Металлический вольфрам, например, используется в ламповых нитях. Сплавы рения используются в гироскопах и ядерных реакторах. А ниобиевые сплавы используются для форсунок жидкостных ракетных двигателей.
9. Черные и цветные металлы

Валы-шестерни из (черной) нержавеющей стали
Черные металлы: Сталь, чугун, сплавы железа.
Цветные металлы: Медь, алюминий, свинец, цинк, серебро, золото.
Термин «железо» происходит от латинского слова «Ferrum», что переводится как «железо». Таким образом, термин «черный металл» обычно означает «содержащий железо», тогда как «цветной металл» означает металлы и сплавы, которые не содержат достаточного количества железа.
Поскольку черные металлы могут иметь широкий спектр легирующих элементов, которые значительно изменяют их характеристики, очень трудно поместить свойства всех черных металлов под один зонт. Тем не менее некоторые обобщения могут быть сделаны, например, большинство черных металлов являются твердыми и магнитными.
Черные металлы используются для применения с высокой нагрузкой и низкой скоростью, в то время как цветные металлы предпочтительны для применения с высокой скоростью и нулевой нагрузкой для применения с низкой нагрузкой.
Сталь является наиболее распространенным черным металлом. Она составляет около 80% всего металлического материала благодаря своей доступности, высокой прочности, низкой стоимости, простоте изготовления и широкому спектру свойств. Она широко используется в строительстве и обрабатывающей промышленности. Фактически, рост производства стали показывает общее развитие промышленного мира.
8. Цветные и благородные металлы

Ассортимент благородных металлов
Цветные металлы: медь, алюминий, олово, никель, цинк
Благородные металлы: родий, ртуть, серебро, рутений, осмий, иридий
Цветные металлы — это обычные и недорогие металлы, которые корродируют, окисляются или тускнеют быстрее, чем другие металлы, когда подвергаются воздействию воздуха или влаги. Они в изобилии встречаются в природе и легко добываются.
Они широко используются в промышленных и коммерческих целях и имеют неоценимое значение для мировой экономики благодаря своей полезности и повсеместности. Некоторые цветные металлы обладают отличительными характеристиками, которые не могут быть продублированы другими металлами. Например, цинк используется для гальванизации стали, чтобы защитить ее от коррозии, а никель — для изготовления нержавеющей стали.
Благородные металлы, с другой стороны, устойчивы к окислению и коррозии во влажном воздухе. Согласно атомной физике, благородные металлы имеют заполненный электрон d-диапазона. В соответствии с этим строгим определением, медь, серебро и золото являются благородными металлами.
Они находят применение в таких областях, как орнамент, металлургия и высокие технологии. Их точное использование варьируется от одного элемента к другому. Некоторые благородные металлы, такие как родий, используются в качестве катализаторов в химической и автомобильной промышленности.
7. Драгоценные металлы

Родий: 1 грамм порошка, 1 грамм прессованного цилиндра и 1 г аргонодуговой переплавленной гранулы
Примеры: палладий, золото, платина, серебро, родий.
Драгоценные металлы считаются редкими и имеют высокую экономическую ценность. Химически они менее реакционноспособны, чем большинство элементов (включая благородные металлы). Они также пластичны и имеют высокий блеск.
Несколько веков назад эти металлы использовались в качестве валюты. Но сейчас они в основном рассматриваются как промышленные товары и инвестиции. Многие инвесторы покупают драгоценные металлы (в основном золото), чтобы диверсифицировать свои портфели или победить инфляцию.
Серебро — второй по популярности драгоценный металл для ювелирных изделий (после золота). Однако его значение выходит далеко за рамки красоты. Оно обладает исключительно высокой тепло- и электропроводностью и чрезвычайно низким контактным сопротивлением. Именно поэтому серебро широко используется в электронике, батареях и противомикробных препаратах.
Классификация по химическим свойствам
6. Щелочные металлы

Твердый металлический натрий
Примеры: натрий, калий, рубидий, литий, цезий и франций.
Щелочь относится к основной природе гидроксидов металлов. Когда эти металлы реагируют с водой, они образуют сильные основания, которые легко нейтрализуют кислоты.
Они настолько реактивны, что обычно встречаются в природе в слиянии с другими веществами. Карналлит (хлорид калия-магния) и сильвин (хлорид калия), например, растворимы в воде и, таким образом, легко извлекаются и очищаются. Нерастворимые в воде щелочи, такие, как фторид лития, также существуют в земной коре.
Одно из самых популярных применений щелочных металлов — использование цезия и рубидия в атомных часах, наиболее точных из известных эталонов времени и частоты. Литий используется в качестве анода в литиевых батареях, композиты калия используются в качестве удобрений, а ионы рубидия используются в фиолетовых фейерверках. Чистый металлический натрий широко используется в натриевых лампах, которые очень эффективно излучают свет.
5. Щелочноземельные металлы

Изумрудный кристалл, основной минерал бериллия.
Примеры: бериллий, кальций, магний, барий, стронций и радий.
Щелочноземельные металлы в стандартных условиях мягкие и серебристо-белые. Они имеют низкую плотность, температуру кипения и температуру плавления. Хотя они не так реакционноспособны, как щелочные металлы, они очень легко образуют связи с элементами. Как правило, они вступают в реакцию с галогенами, образуя галогениды щелочноземельных металлов.
Все они встречаются в земной коре, кроме радия, который является радиоактивным элементом. Радий уже распадался в ранней истории Земли из-за относительно короткого периода полураспада (1600 лет). Современные образцы поступают из цепочки распада урана и тория.
Щелочноземельные металлы имеют широкий спектр применения. Бериллий, например, используется в полупроводниках, теплопроводниках, электрических изоляторах и в военных целях. Магний часто сплавляют с цинком или алюминием для получения материалов со специфическими свойствами. Кальций в основном используется в качестве восстановителя, а барий используется в вакуумных трубках для удаления газов.
4. Переходные металлы
Примеры: титан, ванадий, хром, никель, серебро, вольфрам, платина, кобальт.
Большинство элементов используют электроны из своей внешней оболочки для связи с другими элементами. Переходные металлы, однако, могут использовать две крайние оболочки для соединения с другими элементами. Это химическая особенность, которая позволяет им связываться со многими различными элементами в различных формах.
Они занимают среднюю часть таблицы Менделеева, служа мостом между (или переходом) между двумя сторонами таблицы. Более конкретно, есть 38 переходных металлов в группах с 3 по 12 периодической таблицы. Все они являются пластичными, податливыми и хорошими проводниками тепла и электричества.
Многие из этих металлов, такие как медь, никель, железо и титан, используются в конструкциях и в электронике. Большинство из них образуют полезные сплавы друг с другом и с другими металлическими веществами. Некоторые из них, включая золото, серебро и платину, называются благородными металлами, потому что они крайне инертны и устойчивы к кислотам.
3. Постпереходные металлы

Висмут в виде синтетических кристаллов
Примеры: алюминий, галлий, олово, свинец, таллий, индий, висмут.
Постпереходные металлы в периодической таблице — это элементы, расположенные справа от переходных металлов и слева от металлоидов. Из-за своих свойств они также называются «бедными» или «другими» металлами.
Физически они хрупки (или мягки) и имеют более низкую температуру плавления и механическую прочность, чем переходные металлы. Их кристаллическая структура довольно сложна: они проявляют ковалентные или направленные эффекты связи.
Различные металлы этого семейства имеют различное применение. Алюминий, например, используется для изготовления оконных рам, кухонной посуды, банок, фольги, деталей автомобилей. Оловянные сплавы используются в мягких припоях, оловянных и сверхпроводящих магнитах.
Индиевые сплавы используются для изготовления плоских дисплеев и сенсорных экранов, а галлий — в топливных элементах и полупроводниках.
2. Лантаноиды

1-сантиметровый кусок чистого лантана
Примеры: лантан, церий, прометий, гадолиний, тербий, иттербий, лютеций.
Лантаноиды — это редкоземельные металлы с атомными номерами от 57 до 71. Впервые они были обнаружены в 1787 году в необычном черном минерале (гадолините), обнаруженном в Иттербю, Швеция. Позже минерал был разделен на различные элементы лантаноидов.
Лантаноиды — это металлы с высокой плотностью, плотность которых колеблется от 6,1 до 9,8 г/см³, и они, как правило, имеют очень высокие температуры кипения (1200-3500 °C) и очень высокие температуры плавления (800-1600 °C).
Сплавы лантаноидов используются в металлургии из-за их сильных восстановительных способностей. Около 15 000 тонн лантаноидов ежегодно расходуется в качестве катализаторов и при производстве стекол. Они также широко используются в лазерах и оптических усилителях.
Некоторые исследования показывают, что лантаноиды могут быть использованы в качестве противораковых средств. Лантан и церий, в частности, могут подавлять пролиферацию раковых клеток и способствовать цитотоксичности.
1. Актиниды

Металлический уран, высокообогащенный ураном-235
Примеры: актиний, уран, торий, плутоний, фермий, нобелий, лоренций
Подобно лантаноидам, актиниды образуют семейство редкоземельных элементов с аналогичными свойствами. Они представляют собой серию из 15 последовательных химических элементов в периодической системе от атомных номеров 89 до 103.
Все они радиоактивны по своей природе. Синтетически произведенный плутоний, а также природные уран и торий являются наиболее распространенными актинидами на Земле. Первым актинидом, который был открыт в 1789 году, был уран. И большая часть существующих продуктов актинидов была произведена в 20 веке.
Их свойства, такие как излучение радиоактивности, пирофорность, токсичность и ядерная критичность, делают их опасными для обращения. Сегодня значительная часть (кратковременных) актинидов производится ускорителями частиц в исследовательских целях.
Некоторые актиниды нашли применение в повседневной жизни, например, газовые баллоны (торий) и детекторы дыма (америций), большинство из них используются в качестве топлива в ядерных реакторах и для изготовления ядерного оружия. Уран-235 является наиболее важным изотопом для применения в ядерной энергетике, который широко используется в тепловых реакторах.
Источник https://ru.abcdef.wiki/wiki/Metal_ions_in_aqueous_solution
Источник https://new-science.ru/14-razlichnyh-tipov-metallov/
Источник



