Содержание
Марки стали: виды и классификация сталей по ГОСТ
Все мы привыкли считать, что есть чугун и есть сталь. Однако, если ознакомиться с технологическим процессом производства стали, то мы поймём, что сталь является продуктом переработки чугуна.
Общепринятое определение – сталь является сплавом железа и углерода с содержанием последнего в пределах 0,1 – 2,14%.
Причём, чем меньше доля углерода, тем лучше свариваемость стали и хуже восприимчивость к термообработке
Условия применения стали предъявляют самые разнообразные требования к её физико-химическим свойствам. В связи с этим в состав сплава могут вводиться различные лигатуры, уменьшая долю железа. Поэтому существует уточнённое определение стали – это сплав железа и углерода, но при этом массовая доля железа должна составлять не менее 45%.
Наличие в сплаве железа, углерода и легирующих элементов в тех или иных долях определяет принадлежность стали к какому-либо классу.
Основные параметры
От других материалов сталь отличается своими параметрами: плотностью, удельной тепловой ёмкостью, температурой плавления, показателями линейного теплового расширения и другими. Среди основных характеристик стали следует выделить:
- Плотность: от 7,6 до 7,8 г/см³.
- Удельная тепловая ёмкость при температуре 20 °C: 462 Дж.
- Температура плавления стали: 1400—1500° Цельсия.
- Удельная масса: 75500—77500 Н/м³.
- Удельная теплота плавления: 84 кДж/кг.
- Показатель линейного теплового расширения (нержавеющей): 11,0 * 10 − 6 / °C.
- Коэффициент тепловой проводимости при t = 100° Цельсия (хромоникельвольфрамовой: 15,5; дюралюминиевой: 56,3 Вт/(м·К).
- Лимит прочности при растяжении и сопротивлении (для конструкций: 373−412 мПа; кремнехромомарганцовистой: 1,52 ГПа).
- Модуль упругости стали (или модуль Юнга): 200 тысяч (Е, мПа). В таблице упругости некоторых веществ приводится также значение, равное 2 039 400 (Е, кгс/см²).
- Коэффициент Пуассона: 0,3 единицы.
Качества стали меняются с помощью различных типов обработки: термической, термомеханической, химико-термической. При обрабатывании с целью получить требуемую структуру пользуются полиморфическим свойством — возможностью кристаллической решётки изменять строение при нагревании и охлаждении. Производя закаливание с дальнейшим нагреванием (отпуском), можно добиться получения оптимальной формулы, сочетающей пластичность, твёрдость и плотность стали.
Достоинства и несовершенства стальных сплавов
Поскольку марок стали огромное количество, а изделий из неё ещё больше, то говорить о плюсах и минусах стали бессмысленно. Тем более, что свойства металла во многом зависят от технологий изготовления и обработки.

Вследствие этого можно только выделить несколько общих преимущественных особенностей стали, таких как:
- прочность и твёрдость;
- вязкость и упругость, то есть способность не деформироваться и выдерживать ударные, статические и динамические нагрузки;
- доступность для разных способов обработки;
- долговечность и повышенная износоустойчивость в сравнении с другими металлами;
- доступность сырьевой базы, экономичность производственных технологий.
К сожалению, стали свойственны и некоторые минусы:
- неустойчивость к коррозии, в том числе высокий уровень электрохимической коррозии;
- сталь — тяжёлый металл;
- изготовление изделий из стали производится в несколько этапов, нарушение технологии на любом из них приводит к снижению качества.
Преимущества и недостатки
Стали сочетают большую жёсткость с высокой прочностью. На эти характеристики можно влиять в большом диапазоне с помощью варьирования концентрации углерода, легирующих добавок и технологических процессов (химико-термической и термической обработки).
К основным достоинствам стали можно отнести следующие характеристики:
- высокая твёрдость и прочность;
- множество различных свойств, которые обуславливаются разным составом и способами обрабатывания;
- упругость и вязкость;
- очень высокая износоустойчивость;
- большое распространение сырья и выгодный с экономической точки зрения способ изготовления, что приводит к невысокой цене сплавов.
У стали и продукции, изготовленной из нее, имеются и недостатки. Их меньше, чем достоинств, но все же знать о них необходимо:
- отсутствие временной устойчивости к коррозии (за исключением нержавейки);
- способность накапливать электрическую энергию;
- большой вес;
- многоэтапность изготовления обыкновенных изделий.
Стоит иметь в виду, что сталь — довольно сложный в обработке материал, поэтому для производства продукции из нее необходимы дорогостоящие станки и приспособления.
Качество и способ производства
Безусловно, качество стали зависит от присутствия в ней вредных примесей в виде серы и фосфора. В зависимости от этого показателя классификация сталей выглядит так:
- обычные — серы (S) до 0,06 %, фосфора (P) до 0,07 %;
- качественные — серы до 0,04 %, а фосфора до 0,035 %;
- высококачественные — те же показатели уменьшены до 0,025 %;
- особовысококачественные — менее 0,015 % серы и до 0,025 % фосфора.

Способ изготовления стали предопределяет ее строение, состав и свойства. Так, рядовая сталь (обычная) чаще всего выплавляется в мартене или томасовских и бессемеровских конвертерах, после чего формируется в довольно крупные слитки.
Такая сталь имеет повышенное количество неметаллических добавок. Высококачественные стали изготавливают более совершенными методами, например в электропечи, а особовысококачественные дополнительно очищаются от оксидов и сульфидов при помощи ЭШП — электрошлаковой переплавки.
Такие стали изготавливаются исключительно легированными.
Типология и виды стали
Ранее отмечалось, что базовыми компонентами стали выступает железо и углерод. Исходя из подобного соотношения, сплав, по типологии, характеризуется как легированный, низколегированный и углеродистый. От типологии зависят не только свойства, но и технические характеристики материала.
Качество – показатель соотношения углерода к железу.
При меньшем процентном соотношении, конечный продукт выходит мягким, эластичным и пригоден для дальнейшей обработки и производства холоднокатаной и горячекатаной металлопродукции.
Сталь, с повышенным количеством железа, предназначается для изготовления элементов, служащий в качестве составляющих простых механизмов, не отвечающих за распределения веса или сложные функции.
Сплав, содержащий C2 в процентном соотношении 0.5 к основной массе, является твердым (легированным). Наиболее востребованный продукт в строительной индустрии. Материал играет основную роль, а именно: сдерживание веса конструкции.
Эксплуатационный срок у материала высокий, от 50 до 75 лет. Сплав не подвергается коррозии и не деформируется в неблагоприятном температурном режиме. Проще говоря, любая продукция, изготовленная из твердого сплава, крайне износоустойчива и обладает выдержкой к объёмным нагрузкам.
В строении крупной автомобильной и погрузочной техники легированная и углеродистая сталь играет далеко не последнюю роль, так как данные материалы способны выдержать весомую механическую нагрузку, без деформационных и разрушительных процессов. Но, в момент производственного процесса, возникают определенные трудности со скреплением деталей.
Легированная сталь не сваривается. Соединить несколько элементов можно посредством разогрева до огромной температуры и дальнейшего прикладывания двух деталей.
Сталь обладает антикоррозийными свойствами и не разрушается в местах с повышенной влажностью.
Для чего нужно знать расшифровку марок сталей

Каждому, чья работа связана с металлами, приходилось сталкиваться с понятием «марки стали». Расшифровка маркировки позволяет узнать химической состав, физические свойства сплава. Хотя на первый взгляд маркировка может показаться достаточно сложной, но в ней легко разобраться. Для этого нужно представлять себе принцип ее составления.
Для такого краткого описания сплава используют буквы и цифры, обозначающие химические элементы, их количество. А значит, для грамотной работы со сталями важно знать сами сокращения и как каждый элемент изменяет свойства готового сплава. Тогда удастся предельно точно определить, какими техническими характеристиками обладает определенная марка стали.
Получив заказ на изделие, проектировщики разрабатывают конструкцию, а также выбирают наиболее подходящие для конкретного случая марки сталей, опираясь на расшифровки их свойств. Создаваемое устройство должно функционировать в определенных условиях, поэтому оно рассматривается в процессе движения – так удается понять, какие части будут испытывать повышенные нагрузки.
Чтобы установить требования к прочности элементов, производят расчеты. На следующем этапе подбирают металл в соответствии с марками стали по ГОСТу, который сможет выдерживать многократное нагружение и трение. Чем большую нагрузку будет испытывать изделие, тем более ограничен конструктор в выборе материала. Далее изготавливается прототип устройства из выбранного металла, его испытывают в соответствии с используемыми в конкретной сфере методиками. На этом этапе может быть изменена марка стали. Отметим, что чаще всего для изготовления машин, устройств и сложных механизмов используется именно сталь.
Вне зависимости от конкретной сферы, работа с металлами предполагает понимание их марок, назначений и других характеристик, отображаемых в индексе. Благодаря цифрам и буквам, используемым в шифре, удается максимально быстро разобраться в особенностях металла, не требуя дополнительных уточнений. В этой статье изложен основополагающий принцип классификации, а также простой способ чтения маркировок сталей, наиболее распространенных в производстве.
Виды сталей и особенности их маркировки
Сталь представляет собой сплав железа с углеродом, при этом содержание последнего в ней составляет не более 2,14%. Углерод придает сплаву твердость, но при его избытке металл становится слишком хрупким.
Одним из важнейших параметров, по которому стали делят на различные классы, является химический состав. Среди сталей по данному критерию выделяют легированные и углеродистые, последние подразделяются на мало- (углерода до 0,25%), средне- (0,25–0,6%) и высокоуглеродистые (в них содержится больше 0,6% углерода).

Разновидности сталей
Включая в состав стали легирующие элементы, ей можно придать требуемые характеристики. Именно таким образом, комбинируя вид и количественное содержание добавок, получают марки, обладающие улучшенными механическими свойствами, коррозионной устойчивостью, магнитными и электрическими характеристиками. Конечно, улучшать характеристики сталей можно и при помощи термообработки, но легирующие добавки позволяют делать это более эффективно.
По количественному составу легирующих элементов различают низко-, средне- и высоколегированные сплавы. В первых легирующих элементов не более 2,5%, в среднелегированных – 2,5–10%, в высоколегированных – более 10%.
Классификация сталей осуществляется и по их назначению. Так, выделяют инструментальные и конструкционные виды, марки, отличающиеся особыми физическими свойствами. Инструментальные виды используются для производства штамповых, мерительных, а также режущих инструментов, конструкционные – для выпуска продукции, применяемой в строительстве и сфере машиностроения. Из сплавов, отличающихся особыми физическими свойствами (также называемых прецизионными), изготавливают изделия, которые должны обладать особыми характеристиками (магнитными, прочностными и др.).

Классификация сталей по назначению
Стали противопоставляются друг другу и по особым химическим свойствам. К сплавам данной группы относятся нержавеющие, окалиностойкие, жаропрочные и др. Что характерно, нержавеющие стали могут быть коррозионностойкими и нержавеющими пищевыми – это разные категории.
Кроме полезных элементов, сталь включает и вредные примеси, к основным из которых относятся сера и фосфор. В ней также находятся газы в несвязанном состоянии (кислород и азот), что негативно отражается на ее характеристиках.
Если рассматривать основные вредные примеси, то фосфор увеличивает хрупкость сплава, особенно сильно проявляющуюся при низких температурах (так называемая хладноломкость), а сера вызывает появление трещин в металле, нагретом до высокой температуры (красноломкость). Фосфор, ко всему прочему, значительно уменьшает пластичность нагретого металла. По количественному содержанию этих двух элементов выделяют стали обыкновенного качества (не более 0,06–0,07% серы и фосфора), качественные (до 0,035%), высококачественные (до 0,025%) и особовысококачественные (сера – до 0,015%, фосфор – до 0,02%).
Маркировка сталей также указывает на то, в какой степени из их состава удален кислород. По уровню раскисления выделяют стали:
- спокойного типа, обозначаемые буквосочетанием «СП»;
- полуспокойные – «ПС»;
- кипящие – «КП».
О чем говорит маркировка сталей
Расшифровать марку стали довольно просто, необходимо только владеть определенными сведениями. Конструкционные стали, обладающие обыкновенным качеством и не содержащие легирующих элементов, маркируют буквосочетанием «Ст». По цифре, идущей после букв в названии марки, можно определить, сколько в таком сплаве углерода (исчисляется в десятых долях процента). За цифрами могут идти буквы «КП»: по ним становится ясно, что данный сплав не до конца прошел процесс раскисления в печи, соответственно, он относится к категории кипящего. Если название марки не содержит таких букв, то сталь соответствует категории спокойной.

Химический состав углеродистых конструкционных сталей обыкновенного качества
Конструкционная нелегированная сталь, относящаяся к категории качественных, имеет в своем обозначении две цифры, по ним определяют среднее содержание в ней углерода (исчисляется в сотых долях процента).
Прежде чем приступить к рассмотрению марок тех сталей, которые включают легирующие добавки, следует разобраться в том, как данные добавки обозначаются. Маркировка легированных сталей может включать такие буквенные обозначения:

Список используемых легирующих добавок
Расшифровка марок сталей

Расшифровка обозначений марки стали:
- «Ст» – обыкновенная нелегированная сталь. Так, «Ст3» обозначает металл с содержанием углерода 0,3 %, «Ст3кп» – кипящая сталь, «Сст3сп» – спокойная, «Ст3пс» – полуспокойная, «Ст3св» – свариваемая. Если буквы отсутствуют, то перед вами спокойная сталь.
- Группа «А» – сталь с гарантируемыми механическими свойствами (поставляемый металл не проходит термическую обработку). В данном случае могут встречаться такие маркировки: Ст0 – Ст6.
- Группа «Б» – сплав гарантированного состава, который подвергается термической обработке непосредственно у потребителя. На таком металле может стоять обозначение «БСт3».
- Группа «В» – сталь с гарантированными составом и механическими свойствами, используемая для изготовления сварных конструкций. Например, может маркироваться «ВСт3сп».
- «Пп» – металл, характеризующийся пониженной прокаливаемостью. Используется в качестве материала деталей тонких сечений, требующих высокой поверхностной твердости и подвергаемых термической обработке с нагревом ТВЧ. Пример: «Ст58пп».
- Качественная нелегированная сталь. Например, «Ст20», где содержится 0,2 % углерода, то есть обозначение ведется в сотых долях процента. По такому же принципу расшифровываются «Ст10», «Ст45», «Ст65».
- «К» – качественная углеродистая сталь. Данное обозначение ставиться в конце маркировки, то есть «20К», «15К». Такой металл применяется для производства днищ, котлов, сосудов высокого давления.
- «Л» – литейная конструкционная сталь, буква «Л» должна находиться в конце обозначения. Допустим, «110Г13Л» говорит о том, что данная марка содержит 1,1 % С, около 13 % Mn, является литейной. В соответствии с названием, для производства сплава используется метод литья.
- Конструкционная низколегированная сталь. Маркировка «Ст09Г2С» говорит о доли углерода – 0,09 %, марганца – 2 %, кремния – не более 1–1,5 %, при таком показателе цифра не указывается.
- «С» – строительная сталь. Когда обозначение «С» стоит в начале маркировки, после нее фиксируется минимальный предел текучести. Кроме того, при указании марки сталей используются дополнительные обозначения: «К» – повышенная коррозионная стойкость («С390К», «С375К»); «Т» – термоупрочненный прокат («С345Т», «С390Т»); «Д» – повышенное содержание меди («С345Д», «С375Д»).
- «Е» – металл, имеющий особые магнитные свойства. Данное обозначение также располагается в начале маркировки. Так, из «ЕХ9К5» производят мощные постоянные магниты.
- «У» – углеродистая инструментальная сталь. В качестве примера можно привести «У8ГА» с долей углерода 0,08 %, где «Г» обозначает повышенное содержание марганца, «А» – высокое качество материала.
- «А» – высококачественная сталь, если данная буква расположена в конце маркировки. Например, «40А» обозначает, что эта марка содержит около 0,4 % углерода и относится к сталям высокого качества.
- «Э» – электротехническая сталь, которую еще называют технически чистым железом. Речь идет о тонколистовой стали, которая применяется для изготовления шихтованных магнитопроводов электротехнического оборудования, а именно: для электромагнитов, трансформаторов, генераторов, электродвигателей.
Это такие маркировки, как «10880», «21880», пр. Первая цифра обозначает способ обработки листовой стали: «1» – кованые или горячекатаные марки; «2» – калиброванные марки. Вторая цифра, которая идет за обозначением марки горячекатаной стали, свидетельствует о наличии нормируемого коэффициента старения: «0» – без коэффициента; «1» – с коэффициентом. Третья цифра отображает группу по основной нормируемой характеристике. Две последние цифры используются для фиксации значений основной нормируемой характеристики.
- «А» – автоматная сталь, буква также ставится в начале маркировки. Данный материал отличается низкой пластичностью, поэтому применяется во время производства неответственных деталей, шпилек, болтов, гаек массового производства. Это такие разновидности, как «АС20ХГНМ», «А12», «А20».
- «АС» – автоматная, легированная свинцом. Например, «АС35Г2» содержит 0,35 % углерода, 2 % марганца и свинца не более 1 %.
- «Р» – быстрорежущая инструментальная сталь, данное обозначение также ставится в начале маркировки. Так, в «Р6М5» доля вольфрама составляет 6 %, а молибдена – 5 %.
- «Ш» – шарикоподшипниковая сталь. Отличается повышенной прочностью, износоустойчивостью, выносливостью. Допустим, марка «ШХ9» говорит о содержании хрома 0,9 % и углерода около 1 %.
Примеры маркировки сталей различных видов
Определение марки стали и причисление сплава к определенному виду – это задача, которая не должна вызывать никаких проблем у специалиста. Не всегда под рукой есть таблица, в которой дается расшифровка названий марок, но разобраться с этим помогут примеры, которые приведены ниже.
Конструкционные стали, не содержащие легирующих элементов, обозначаются буквосочетанием «Ст». Цифры, стоящие следом, – это содержание углерода, исчисляемое в сотых долях процента. Несколько иначе маркируются низколегированные конструкционные стали.
К примеру, в стали марки 09Г2С 0,09% углерода, а легирующие добавки (марганец, кремний и др.) содержатся в ней в пределах 2,5%. Очень похожие по своей маркировке 10ХСНД и 15ХСНД отличаются разным количеством углерода, а доля каждого легирующего элемента в них составляет не больше 1%.
Именно поэтому после букв, обозначающих каждый легирующий элемент в таком сплаве, не стоит никаких цифр.
20Х, 30Х, 40Х и др. – так маркируются конструкционные легированные стали, преобладающим легирующим элементом в них является хром.
Цифра в начале такой марки – это содержание углерода в рассматриваемом сплаве, исчисляемое в сотых долях процента.
За буквенным обозначением каждого легирующего элемента может быть проставлена цифра, по которой и определяют его количественное содержание в сплаве. Если ее нет, то указанного элемента в стали содержится не больше 1,5%.
Можно рассмотреть пример обозначения хромокремнемарганцевой стали 30ХГСА. Она, согласно маркировке, состоит из углерода (0,3%), марганца, кремния, а также хрома. Каждого из данных элементов в ней содержится в границах 0,8–1,1%.
Обозначение сталей с легирующими элементами
Как сказано выше, классификация сталей с легирующими элементами включает несколько категорий. Маркировка легированных сталей составляется по определенным правилам, знание которых позволяет достаточно просто определить категорию конкретного сплава и основную область его применения.
В начальной части названий таких марок находятся цифры (две или одна), показывающие содержание углерода. Две цифры указывают на его среднее содержание в сплаве в сотых долях процента, а одна – в десятых. Есть и стали, не имеющие в начале названия марки цифр.
Это означает, что углерод в этих сплавах содержится в пределах 1%.
Пример маркировки легированной стали
Буквы, которые можно увидеть за первыми цифрами названия марки, указывают на то, из чего состоит данный сплав.
За буквами, дающими информацию о том или ином элементе в его составе, могут стоять или не стоять цифры.
Если цифра есть, то по ней определяется (в целых процентах) среднее содержание указанного буквой элемента в составе сплава, а если цифры нет, значит, данный элемент содержится в пределах от 1 до 1,5%.
В конце маркировки отдельных видов сталей может стоять буква «А». Это говорит о том, что перед нами высококачественная сталь. К таким маркам могут относиться и углеродистые стали, и сплавы с легирующими добавками в своем составе. Согласно классификации, к данной категории сталей причисляются те, в которых сера и фосфор составляют не более 0,03%.
Сталь: классификация, применение, маркировка
Прежде всего стоит сказать, что сталь бывает углеродистая и легированная. Это зависит от того, были ли добавлены в сплав специальные легирующие элементы — алюминий, никель, хром, молибден, титан, бор, ванадий, марганец и другие. Все эти добавки применяются для повышения специфических свойств стали, а наилучший результат достигается комплексным легированием.
В общем случае стали классифицируют:
- по назначению;
- по качеству;
- по способу производства;
- по микроструктуре;
- по химическому составу.
Виды сталей и их классификация
Черная металлургия производит множество видов стали с различными характеристиками, материалы классифицируют по способу производства,химическому составу, назначению, качеству, степени раскисления, структуре.
Классификация по химическому составу
В естественной среде железо реагирует с окислителями, галогенами, фосфором и серой. Для очищения сырья и преобразования оксидных соединений в роли восстановителя сначала применяли каменный уголь. Так при горении в недостатке кислорода, выплавляли чугун, из которого уже частично удалены оксиды и примеси, а доля углерода составляет не менее 2,14%. Для выплавления стали из полученной массы необходимо уменьшить его концентрацию до 2%.
Углеродистые
По составу отличаются от чугуна только концентрациями. При обработке снижается количество углерода и вредных включений. Соотношение кремния и марганца – может корректироваться для придания дополнительной прочности и стойкости к коррозии. По количеству углеродных соединений различают следующие группы:
- Высокоуглеродистая (0,6-2%);
- Среднеуглеродистая (0,25-0,55%);
- Низкоуглеродистая (до 0,25%).
Углеродная составляющая участвует в формировании карбидов и укрепляет структуру на молекулярном уровне. Чем выше содержание, тем больше стойкость к механическим нагрузкам, особенно ударным. Понижение придает пластичность и возможность выпускать изделия повышенной точности. Из этих сплавов получают инструменты (топоры, валы), детали, испытывающие большое напряжение (оси, арматура) и малонагруженные (зубчатые колеса, пружины). Расшифровка характеристик стали производится по буквам:
- Ст – сталь;
- Цифра – номер, согласно регламенту, ГОСТ 380-2005;
- Г – марганец выше 0,8%;
- КП, ПС или СП – метод раскисления.
Группу объединяет название «конструкционные», их обозначают маркировками: Ст0, Ст1кп, Ст1пс, Ст1сп, Ст2кп, Ст2пс, Ст2сп, Ст3кп, Ст3пс, Ст3сп, Ст3Гпс, Ст3Гсп, Ст4кп, Ст4пс, Ст4сп, Ст5пс, Ст5сп, Ст5Гпс, Ст6пс, Ст6сп.
Отдельно выделяют группу с названием «инструментальные», они содержат 0,7% углерода и дополнительно очищаются от вредных составляющих. Расшифровка букв в обозначении согласно ГОСТ 1435-99:
- У – углеродистая;
- Цифры: углеродная концентрация в десятых долях процента;
- Г – марганец выше 0,33%;
- А – повышенное качество, серы не более 0,03%, фосфора – до 0,035%.
Инструментальные нелегированные стали обозначают следующими маркировками: У7; У8; У8Г; У9; У10; У11; У12; У13; У7А; У8А; У8ГА; У9А; У10А; У11А; У12А; У13А.
Легированные
Для придания специальных свойств в расплав добавляют различные присадки. Процесс называют легированием. По соотношению легирующих элементов марки разделяют на низколегированные (до 2,5%), среднелегированные (до 10%) и высоколегированные (до 50%).
В таблице приведены металлы, включения примесей и их обозначения в маркировке:
| Марганец – Mn | Г |
| Хром – Cr | Х |
| Никель – Ni | Н |
| Титан – Ti | Т |
| Молибден – Mo | М |
| Бериллий – Be | Л |
| Медь – Cu | Д |
| Азот – N | А |
| Ванадий – V | Ф |
| Ниобий – Nb | Б |
| Алюминий –Al | Ю (от ювенал) |
| Селен – Se | E |
| Кобальт – Co | К |
| Бор – B | P |
| Фосфор – P | П |
| Кремний –Si | С (от силициум) |
| Цирконий –Zr | Ц |
Например, 08Х18Н10 расшифровывается как 0,08% углерода (С), 18 % хрома (Cr), 10% никеля (Ni). Обозначаются не все составляющие, а только говорящие об основных свойствах. Легирование применяется во всех случаях, когда неприемлемо использование углеродистых сплавов. Технический процесс сложнее и дороже, но присадки помогают продлить срок службы в сложных условиях или создать материал со специальными возможностями.
Также в начале маркировки могут присутствовать такие обозначения:
Р — быстрорежущая;
Ш — шарикоподшипниковая;
А — автоматная;
Э — электротехническая.
У этих марок есть ряд особенностей:
- в шарикоподшипниковых сталях содержание хрома указывается в десятых долях процента (например, сталь ШХ4 содержит 0,4% хрома);
- в марках быстрорежущей стали после буквы Р сразу ставится число, указывающее содержание вольфрама в процентах. Также все быстрорежущие стали содержат 4% хрома (Х).

Пример расшифровки стали 30ХГС
Классификация по качеству
Чем меньше осталось вредных включений, тем выше качественные характеристики, но иногда это не оправдано экономически. Система стандартизации предусматривает три класса.
Обыкновенного качества
К этому виду относятся углеродистая сталь. Она производится в печи или на конвертере с применением кислорода. Сталь обыкновенного качества имеет доступную цену, широкую сферу применения, легко обрабатываются, но не отличаются устойчивостью к износу или прочностью.
Качественные
Она может быть как углеродистой, так и легированной. По сравнению с предыдущим типом этот состав произведен в соответствии с более строгими требованиями. Они производятся с соблюдением строгих характеристик плавления. Качественная сталь стоит дороже и применяется для изготовления элементов, предназначенных для высокого уровня нагрузок.
Высококачественные
Такой вид стали производится более современными методами, например, выплавке в электрических печах. Этот способ позволяет добиться минимального содержания включений газов и вредных неметаллических примесей, что обеспечивает высокие механические свойства материала. Сталь высокого качества имеет более высокую стоимость и используется для создания особо прочных конструкций.
Особовысококачественные
Это сплавы с минимально возможным количеством примесей. Они имеют самое высокое качество из представленных и имеют соответствующую цену, приближенную к драгоценностям. Особовысококачественная сталь – это легированная сталь, которая используется в уникальных случаях. Например, для производства деталей космических кораблей.
Классификация по структуре
Структура стали формируется в процессе ее изготовления, во время отливки и обработки под воздействием высоких температур. Химические связи материала определяют ее отношение к какому-либо классу. Это отношение учитывается для применения стали в той или иной области. Рассмотрим эти классы подробнее:
- Аустенит. Этот класс отличается прочностью и однородностью. Они устойчивы к жару и образованию ржавчины, могут использоваться для работы в опасных условиях или перевозки агрессивных элементов.
- Феррит. Представители класса ферритов – магнетики, благодаря чему оптимальны для использования в радиотехнике и электронике для изготовления антенн и другого оборудования.
- Мартенсит. Этот вид стали получают при помощи процедуры легирования и термической обработки. Материал может возвращать форму после механической обработки. Применение представителей мартенсита осложняется дополнительными требованиями к обработке.
- Перлит. Перлитом называется распад при охлаждении после нагрева. Такое состояние создается искусственным способом для пластической деформации.
- Цементит. Представители вида физически упругие и твердые.
Аустенит
Атомы углерода находятся внутри ячеек кристаллической решетки металла. Легирующие элементы способны замещать атомы железа и вставать на их место. Аустениты отличаются прочностью и однородностью, не магнитны, относятся к коррозийно-стойким и жаропрочным материалам, применяются для транспортировки агрессивных веществ, работы в особо сложных условиях.
Феррит
Ферритная решетка похожа на куб правильной формы. Поликристаллическое строение делает ферриты мягкими, при переохлаждении зерна становятся крупными, увеличивается хрупкость. Представители класса являются сильными магнетиками, поэтому используются в радиотехнике и электронике для поглощения электромагнитных волн, выпуска антенн и сердечников.
Мартенсит
При закаливании и охлаждении формируется игольчатое строение, при этом атомы железа смещаются на вершины ячеек, а углеродные концентрируются в центре. Это создает внутренние напряжения. Интересно, что мартенситовое превращение происходит в определенных температурных промежутках, при котором достигается предельная твердость. Явление сопровождается возникновением «памяти метала». Сталь, находящаяся в таком состоянии способна вернуть форму после механической деформации.
Мартенсит получают различными методами термообработки и легирования, присадки помогают стабилизации решетки. Степень зависит от назначения, иногда необходимо полное прокаливание, а если этого не требуется, то воздействуют лишь на поверхностные слои. Применение осложняется дополнительными требованиями к обработке, особенно сварке. Уникальные свойства пока не изучены до конца.
Перлит
На этой стадии облегчается механическая обработка. Перлит – явление распада при охлаждении после нагрева. Зерна измельчаются или расслаиваются на пластинки. Состояние создают искусственно для пластической деформации.
Цементит
Особо устойчивое состояние. Решетка FeC3 имеет ромбическую форму, физически цементит очень тверд и хрупок. Формируется при кристаллизации расплава чугуна. В сталях образуется при охлаждении аустенита и нагревании мартенсита (разупрочняющий отжиг).
В металлургии термообработка производится для получения лучших эксплуатационных характеристик конкретного состава и состоит из многочисленных процедур нагревов и охлаждений в разной температуре: сфероидизация, гомогенизация, изотермический отжиг, разупрочнение, стабилизация.
Классификация сталей по назначению
Конструкционные – стали, предназначенные для изготовления деталей машин и элементов строительных конструкций.
Конструкционные стали подразделяются на:
- обыкновенного качества;
- улучшаемые;
- цементируемые;
- автоматные;
- высокопрочные;
- рессорно-пружинные.
Инструментальные – стали, применяемые при изготовлении режущих и измерительных инструментов.
Инструментальные стали подразделяются на подгруппы по изготовлению:
- для режущего инструмента;
- для измерительного инструмента;
- для штампово-прессовой оснастки.
Специального назначения – стали с особыми физическими и механическими свойствами.
Стали специального назначения подразделяются на:
- нержавеющие (коррозионно-стойкие);
- жаростойкие;
- жаропрочные;
- износостойкие;
- магнитные;
- немагнитные и т.д.
Конструкционные

Самые распространенные. Их применяют для создания металлоконструкций – машин и станков, крупных и маленьких механизмов и деталей. Все их делят на машиностроительные и арматурные, или просто строительные. Последние удобно сваривать, и при этом соединении они остаются очень прочными. Также важно, какая группа причислена марке – специальное или общее назначение. После отлива обычно обязательно проводится термообработка – закалка и отпуск или нормализация.
Строительные
К ним относится углеродистая и низколегированная сталь. Из нее изготавливают сложные конструкции, в которых нагрузка распределяется одинаково на все области. К строительной стали не предъявляются особые требования, кроме податливости к сварке.
Для холодной штамповки
Холодная штамповка значительно меняет форму и размеры металлической заготовки. К этому виду предъявляются следующие требования – высокий уровень пластичности и стойкости на разрыв.
Пружинные
Пружинные марки стали могут выдерживать многократные упругие деформации «усталости», присущей металлам. Они широко применяются в производстве автомобилей, транспортной отрасли и других сферах, где есть необходимость в амортизации, возврате элементов в первоначальное положение после выполнения рабочих функций. Углеродистые сплавы могут легироваться кремнием, бором и другими химическими элементами.
Цементируемые
Назначение цементируемой стали – производство деталей и узлов, которые подвергаются периодическим нагрузкам. Цементация – это процедура, в ходе которой повышается стойкость материала к износу.
Подшипниковые
Назначение подшипниковой стали – эксплуатация оборудования и механизмов, использующих подшипники. В этом случае материал должен иметь высокую прочность, устойчивость к износу и быть выносливым. К минимуму должны быть сведены посторонние вещества и неоднородная текстура. Подшипниковая сталь подвергается специальной термической обработке и уплотнению.
Высокопрочные
Для создания высокопрочного вида сталей подбирается специальный состав и соотношение легированных элементов, а также программы обработки. В ходе процедуры достигается высокая прочность материала, которая в несколько раз превосходит параметры конструкционной стали. Высокопрочные элементы используются в узлах особой прочности.
Износостойкие
Износостойкую сталь получают благодаря добавлению большого количества марганца. Ее назначение – изготовление узлов, которые постоянно подвергаются трению и большим нагрузкам (как динамическим, так статистическим). Например, из износостойкой стали производят гусеницы, горное оборудование и оборудование для рельсов.
Стали коррозионно-стойкие (нержавеющие стали)
Коррозионно-стойкие (нержавеющие) стали — легированные стали с большим содержанием хрома (не менее 12%) и никеля. Хром образует на поверхности изделия защитную (пассивную) оксидную пленку.
Углерод в нержавеющих сталях — нежелательный элемент, а чем больше хрома,тем выше коррозионная стойкость. Структура для наиболее характерных сплавов этого назначения может быть:
- ферритно-карбидной и мартенситной (12Х13, 20Х13, 20Х17Н2, 30Х13, 40Х13, 95Х18 — для слабых агрессивных сред (воздух.вода, пар);
- ферритной (15Х28)
Коррозионностойкие стали и сплавы классифицируют в зависимости от агрессивности среды, в которой они используются, и по их основному потребительскому свойству на собственно
- коррозионно-стойкие
- жаростойкие
- жаропрочные
- криогенные.
Жаропрочные стали
Жаропрочные стали способны работать в нагруженном состоянии при высоких температурах в течение определенного времени и при этом обладают достаточной жаростойкостью.
Данные стали и сплавы применяются для изготовления труб, клапанных, паро- и газотурбинных деталей (роторы, лопатки, диски и др.).
Для жаропрочных и жаростойких машиностроительных сталей используются малоуглеродистые (0,1-0,45%С) и высоколегированные (Ѕі,Ст, Ні, Со и др.).
Жаропрочные стали и сплавы в своем составе обязательно содержат никель, который обеспечивает существенное увеличение предела длительной коррозионной прочности при незначительном увеличении предела текучести и временного сопротивления, и марганец.
Они могут дополнительно легироваться молибденом, вольфрамом, ниобием, титаном, бором, иодом и др. Так, микролегирование бором, а также редкоземельными и некоторыми щелочноземельными металлами повышает такие характеристики, как число оборотов при кручении, пластичность и вязкость при высоких температурах,
Рабочие температуры современных жаропрочных сплавов составляют примерно 45-80% от температуры плавления. Эти стали классифицируют по температуре эксплуатации (ГОСТ 20072-74):
- при 100-550°С (15ХМ, 12Х1МФ, 25Х2М1Ф, 20Х3МБФ)
- при 500-600°С (15Х5М, 40Х10С2М, 20Х13)
- при 500-650°С (12Х18Н9Т, 45Х14Н14В2М, 10Х11Н23Т3МР, ХН60Ю, ХН70Ю,ХН77ТЮР, ХН56ВМКЮ,ХН62МВКЮ
Криогенные стали
Криогенные машиностроительные стали и сплавы (ГОСТ 5632-72) по химическому составу являются низкоуглеродистыми (О,10% С) и высоколегированными (Сг, Ni, Мn и др.) сталями аустенитного класса (08Х18Н10, 12Х18Н10Т, 03Х20Н16АГ6, 03Х13АГ19 и др.).
Основными потребительскими свойствами этих сталей являются пластичность и вязкость, которые с понижением температуры (от +20 до -196°С) либо не меняются, либо мало уменьшаются, т.е. не происходит резкого уменьшения вязкости, характерного при хладноломкости.
Криогенные машиностроительные стали классифицируют по температуре эксплуатации в диапазоне от -196 до -296°С и используют для изготовления деталей криогенного оборудования.
Инструментальные
Их используют для создания инструментов – режущие кромки по металлу, прессы и пр. Это отличные сверла, резцы и другие вещи. Сплав отличается повышенным количеством углерода – не менее 0,7%.
К характерным чертам следует отнести прочность, поскольку сталь должна быть более крепкой при механическом соприкосновении с другой. Но износостойкость может быть недостаточно высокой.
Для режущих инструментов

Главное требование к сплавам этой группы — способность сохранять заданную твердость, прочность и термостойкость при длительных механических и термических нагрузках.
Инструмент из инструментальной стали для режущих инструментов
Такие сплавы отличаются весьма высокой стоимостью, поэтому режущий инструмент, как правило, не делают целиком из инструментальных материалов, а используют режущие пластины или поверхности другой формы, вплавляемые или закрепляемые на основе, сделанной из конструкционных марок. Это позволяет существенно снизить стоимость и продлить срок службы инструмента
Группа также подразделяется на:
- Углеродистые инструментальные сплавы. В их состав входит от 0,5 до 1,3% углерода. Применяется для обычного режущего инструмента массового применения.
- Легированные инструментальные. Для повышения прочности и теплостойкости (до 300 °С) применяют легирующие добавки – хром, ванадий и другие от 1 до 3%. Из таких материалов делают сверла, фрезы и протяжки.
- Быстрорежущие. Применяются для высокоэффективного прогрессивного инструмента, обладающего высокой теплостойкостью — до 660 °С.
Высокая стоимость прогрессивного инструмента с лихвой окупается в общем случае повышением производительности оборудования, сокращением износа станков в расчете на одно изделие, снижением трудоемкости и повышением темпа выпуска изделий. Экономический эффект зависит от размера серии.
Стали для измерительных инструментов
Основное требование к материалам этой группы — это стабильность формы и размеров в процессе измерения и хранения.

Изделие из стали для измерительных инструментов
Второе по значимости свойство — это исключительное качество поверхности, хорошая обрабатываемость и особенно шлифуемость. Разумеется, требования к износостойкости и твердости также остаются в силе. Применяют как недорогие углеродистые славы, так и легированные хромом, никелем и другими присадками. Изделия подвергают цементации и закалке для улучшения качества поверхности и повышения износостойкости. В последнее время, с развитием передовых бесконтактных способов и средств измерения, таких, как лазерные, ультразвуковые и программно-аппаратное интегрированные в обрабатывающие центры, потребность в сплавах этой группы несколько снизилась. Но они по-прежнему востребованы как на опытных производствах, так и при изготовлении и поверке тех самых прогрессивных средств измерения.
Штамповые стали
Сплавы этой группы должны отличаться особой твердостью, прокаливаемостью и термостойкостью. Главное же требование к ним — высокая износостойкость и постоянство формы изделия. Сюда входят сплавы:
- Холодной штамповки. К основным требованиям — твердости, износостойкости, стабильности формы и размеров — добавляются термостойкость и высокая вязкость, поскольку изделия работают в условиях высокого давления и ударов. Изготавливаются на основе хромосодержащих лигатур с добавлением других элементов. Многие сорта взаимозаменяемы с быстрорежущими.
- Горячей штамповки. К требованиям для сплавов холодной штамповки добавляется повышенная прочность и вязкость при сильном нагревании (до 500 °С) и высокая теплопроводность для избегания перегрева. Легируются высокими содержаниями хрома, ванадия, никеля и др.
Валковые стали
Применяются для изготовления разнообразных валков прокатных станов, ножей для резки металла, матриц и пуансонов. Применяются также для изготовления уникальных высоконагруженных узлов бумагоделательного и горного оборудования.

К ним выдвигаются следующие требования:
- Высокая прокаливаемость для достижения необходимой прочности по всей детали, достигающей иногда десятка метров. При этом закалку проводят с медленным графиком охлаждения в масле.
- Глубокая прокаливаемость. Для обеспечения постоянства размеров и формы выпускаемого проката важно, чтобы зона высокой прочности не сосредотачивалась в приповерхностном слое, а равномерно проникала по всему объему изделия, достигающего в диаметре нескольких метров, гарантируя заданную жесткость всего валка. Этого добиваются доведением углерода до 0,8%, специальным подбором лигатур (включая кремний и бор) и тщательным соблюдением программы термообработки, в особенности в части графика охлаждения.
- Высокая износостойкость. Гарантирует долгую бесперебойную работу всего прокатного стана, стабильность параметров проката и снижение расходов на внеплановый ремонт и последующую настройку оборудования.
- Достаточная контактная прочность. Значение параметра с заданным запасом должно превышать напряжения, возникающие в ходе технологического процесса, учитывая как нагрузки от веса самого оборудования, так и возникающие вследствие сопротивления прокатываемого материала.
- Минимизация собственных деформаций, нарушения соосности и коробления в ходе термообработки, а также максимально возможная стабильность формы и размеров изделия при его работе.
Завершается перечень требований приемлемой обрабатываемостью изделий и отличной шлифуемостью и полируемостью поверхностей. Это позволит получать прокат стабильно высокого качества.
Стали с особенными химическими и физическими свойствами

Кроме всех вышеперечисленных, существуют также марки сталей с особыми свойствами:
- электротехническая сталь — сплав железа и кремния, иногда легированный алюминием; применяется при производстве магнитопроводов разнообразного электротехнического оборудования;
- суперинвар — сплав железа, никеля и кобальта, применяемый при изготовлении высокоточного оборудования;
- жаростойкая — обладает повышенной стойкостью против разрушения при температурах от 900 °C, легируется алюминием, кремнием, никелем;
- жаропрочная — применяется для изготовления деталей газотурбинных установок, такие стали призваны работать в нагруженном состоянии при высокой температуре в течение некоторого времени.
Классификация сталей по степени раскисления
По степени раскисления стали классифицируют на:
- спокойные (сп);
- полуспокойные (пс);
- кипящие (кп).
Раскислением называют процесс удаления кислорода из жидкой стали.
Спокойные стали раскисляют марганцем, алюминием и кремнием в плавильной печи и ковше. Они затвердевают в изложнице спокойно, без газовыделения, с образованием в верхней части слитков усадочной раковины.
Дендритная ликвация вызывает анизотропию механических свойств. Пластические свойства стали в поперечном (по отношению к направлению прокатки или ковки сечении значительно ниже, чем в продольном.
Зональная ликвация приводит к тому, что в верхней части слитка содержание серы, фосфора и углерода увеличивается, а в нижней – уменьшается. Это приводит к значительному ухудшению свойств изделия из такого слитка, вплоть до отбраковки.
Кипящие стали раскисляют только марганцем, что недостаточно. Перед разливкой в них содержится повышенное количество кислорода, который при затвердевании слитка частично реагирует с углеродом и выделяется в виде газовых пузырей окиси углерода, создавая впечатление «кипения» стали.
Кипящая сталь практически не содержит неметаллических включений продуктов раскисления. Эти стали выплавляют низкоуглеродистыми и с очень малым содержанием кремния (менее 0,07 %), но с повышенным количеством газообразных примесей.
При прокатке слитков газовые пузыри, заполненные окисью углерода, завариваются. Листовой прокат из такой стали предназначен для изготовления деталей кузовов автомобилей вытяжкой, имеет хорошую штампуемость в холодном состоянии.
Полуспокойные стали по степени их раскисления занимают промежуточное положение между спокойными и кипящими сталями. Частично их раскисляют в плавильной печи и в ковше, а окончательно – в изложнице за счет содержащегося в металле углерода. Ликвация в слитках полуспокойной стали меньше, чем в кипящей, и приближается к ликвации в слитках спокойной стали.
Кипящая
Для получения используют минимальное количество реагентов, поэтому остается много кислорода и углекислого газа. Слитки имеют неоднородное строение, в одной части оседают вредные примеси, поэтому до 5% готового слитка удаляется. Материал с низкими характеристиками, хрупкий. Воздух концентрируется в сердцевине, но наружная корка может иметь достаточную прочность. Возможно изготовление крепежных деталей котлов и конструкций, контактирующих с взрывоопасными средами. Главный недостаток: быстрая коррозия.
Полуспокойная
Промежуточное состояние. Упрощенные технические циклы удешевляют производство, а свойства достаточны для выпуска несущих элементов сварных и клепаных конструкций. Из Ст5пс изготовляют болты, гайки, упоры, которые можно использовать в плюсовых температурах и низкой влажности воздуха.
Спокойная
Благодаря сложным технологическим процессам присутствие газов и неметаллических включений минимально, а структура однородна. Из слитков изготовляют металлоконструкции, детали или используют для создания дорогостоящих сплавов.
Обозначение сталей с легирующими элементами
Далее сложнее, так как вступает в игру легирующий состав. Ниже покажем таблицу – буквенное сочетание:
| Литера в маркировке | Знак химэлемента | Наименование |
| Х | Cr | Хром |
| С | Si | Кремний |
| Т | Ti | Титан |
| Д | Cu | Медь |
| В | Wo | Вольфрам |
| Г | Mn | Марганец |
| Ф | W | Ванадий |
| H | Ni | Никель |
| K | Co | Кобальт |
| M | Mo | Молибден |

Покажем на примере определенной марки:
Первая цифра всегда указывает на количество сотых частей углерода. Затем перечисляются буквенные обозначения, которые отвечают за добавки. Если рядом с ним не стоит буква, значит этого компонента меньше, чем 1%.
Сзади самая последняя буква (в примере не указана) может быть «А» или «Ш» – это высококачественная или особовысококачественная сталь, соответственно.
Влияние углерода и легирующих элементов на свойства стали
Стали промышленного производства являются сложными по химическому составу сплавами железа и углерода. Кроме этих основных элементов, а также легирующих компонентов в легированных сталях, материал содержит постоянные и случайные примеси. От процентного содержания этих компонентов и зависят основные характеристики стали.
Определяющее влияние на свойства стали оказывает углерод. После отжига структура этого материала состоит из феррита и цементита, содержание которого увеличивается пропорционально росту концентрации углерода. Феррит является малопрочной и пластичной структурой, а цементит – твердой и хрупкой. Поэтому повышение содержания углерода приводит к увеличению твердости и прочности и снижению пластичности и вязкости. Углерод меняет технологические характеристики стали: обрабатываемость давлением и резанием, свариваемость. Увеличение концентрации углерода приводит к ухудшению обрабатываемости резанием из-за упрочнения и снижения теплопроводности. Отделение стружки от стали с высокой прочностью повышает количество выделяемой теплоты, что провоцирует уменьшение стойкости инструмента. Но низкоуглеродистые стали с малой вязкостью также обрабатываются плохо, так как образуется с трудом удаляемая стружка.
Наилучшую обрабатываемость резанием имеют стали с содержанием углерода 0,3-0,4%.
Увеличение концентрации углерода приводит к снижению способности стали к деформации в горячем и холодном состояниях. Для стали, предназначенной для сложной холодной штамповки, количество углерода ограничено 0,1%.
Хорошей свариваемостью обладают низкоуглеродистые стали. Для сварки средне- и высокоуглеродистых сталей используют подогрев, медленное охлаждение и прочие технологические операции, предотвращающие появление холодных и горячих трещин.
Для получения высоких прочностных свойств количество легирующих компонентов должно быть рациональным. Избыток легирования, исключая введение никеля, приводит к снижению запаса вязкости и провокации хрупкого разрушения.
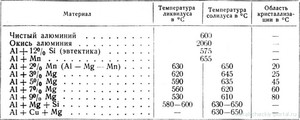
Учимся плавить аллюминий
Чтобы правильно плавить металл, необходимо учитывать температуру плавки алюминия. Чистый сплав легко плавится уже при +660°С, а оксидная пленка только при +2300°С. Опасно самостоятельно плавить порошок, он способен воспламениться. Кусочки алюминия плавят сухими, вода в расплаве способна спровоцировать взрыв.
О температуре плавления
Необходимо помнить: алюминий очень легко поддается литью и начинает превращаться в жидкую субстанцию уже при температуре в 660 градусов. Для того чтобы понять, что этот показатель довольно низкий, достаточно сравнить его с температурами плавления других металлов, которые также нередко используются для изготовления тех или иных, нужных в обиходе предметов.
- сталь начинает плавиться лишь при температуре в 1300 градусов;
- чугун — при 1100 градусах.
Но все же, хоть температура плавления алюминия по Цельсию и не слишком высока по сравнению со многими другими металлами, достичь 600 градусов в домашних условиях с использованием обыкновенной газовой или электрической плиты довольно трудно.
Уменьшение температуры
Прежде чем подвергать металл плавлению, можно специальными методами уменьшить его температуру плавления, например, использовать в виде порошка. В этом случае он начнет плавиться чуть быстрее. Но при этом он становится опасным, так как взаимодействуя с атмосферным кислородом, может окислиться или воспламениться. А в результате окисления, как мы помним из школьного курса химии, образуется оксид алюминия; и температура, при которой начинает плавиться это вещество, уже превышает две тысячи градусов.
Вообще избежать образования оксида не получится, если заниматься плавлением алюминия, но уменьшить количество лишнего вещества вполне возможно. При плавлении алюминия нужно не допускать попадания в вещество воды. Ведь если это случится, то произойдет взрыв.
Перед началом процесса нужно убедиться в том, что сырье является абсолютно сухим. Чаще всего в качестве исходного материала применяется алюминиевая проволока. Предварительно ее нужно с помощью ножниц разделить на множество мелких по длине кусочков. А для того, чтобы уменьшить площадь контакта с содержащимся в атмосфере кислородом, эти кусочки прессуются пассатижами.
Не всегда есть необходимость создать алюминиевое изделие высокого качества, поэтому вовсе не обязательно всегда использовать порошок или мелко нарезанную и плотно сдавленную проволоку. Можно взять любой предмет, который уже был использован, например, банку, в которой хранились консервы. Но перед плавкой нужно лишить ее нижнего шва или обрезать профиль. Полученное сырье может быть окрашено или испачкано. Не нужно об этом беспокоиться. Все, что имеется лишнее на поверхности, быстро отходит в виде шлаков.
Температура плавления чистого алюминия
Плавление алюминия, как и других веществ, происходит при подводе к нему тепловой энергии, снаружи или непосредственно в его объём, как это происходит, например, при индукционном нагреве.
Температура плавления алюминия зависит от его чистоты:
- Температура плавления сверхчистого алюминия 99,996 %: 660,37 °С.
- При содержании алюминия 99,5 % плавление начинается при 657 °С.
- При содержании алюминия 99,0 % плавление начинается при 643 °С.
Температура плавления металлов
Металлы и неметаллы
Любой кусок металла, например, алюминия, содержит миллионы отдельных кристаллов, которые называются зернами. Каждое зерно имеет свою уникальную ориентацию атомной решетки, но все вместе зерна ориентированы внутри этого куска случайным образом. Такая структура называется поликристаллической.
Аморфные материалы, например, стекло, отличаются от кристаллических материалов, например, алюминия, по двум важным отличиям, которые связаны друг с другом:
- отсутствие дальнего порядка молекулярной структуры
- различия в характере плавления и термического расширения.
Различие молекулярной структуры можно видеть на рисунке 1. Слева показана плотно упакованная и упорядоченная кристаллическая структура. Аморфный материал показан справа: менее плотная структура со случайным расположением атомов.

Рисунок 1 – Структура кристаллических (а) и аморфных (б) материалов.
Кристаллическая структура: упорядоченная, повторяющаяся и плотная,
аморфная структура – более свободно упакованная
с беспорядочным расположением атомов.
Плавление металлов
Это различие в структуре проявляется при плавлении металлов, в том числе, плавлении алюминия различной чистоты и его сплавов. Менее плотно упакованные атомы дают увеличение объема (снижение плотности) по сравнению с тем же металлом в твердом кристаллическом состоянии.
Металлы при плавлении испытывают увеличение объема. У чистых металлов это объемное изменение происходит весьма резко и при постоянной температуре – температуре плавления, как это показано на рисунке 2. Это изменение представляет собой разрыв между наклонными линиями по обе стороны от точки плавления. Обе эти наклонные линии характеризуют температурное расширение металла, которое обычно является различным в жидком и твердом состоянии.

Рисунок 2 – Характерное изменение объема чистого металла
по сравнению с изменением объема аморфного материала [4]:
Tg – температура стеклования (перехода жидкого состояния в твердое);
Tm – температура плавления
Теплота плавления
С этим резким увеличением объема при переходе металла из твердого состояния в жидкое связано определенное количество тепла, которое называется скрытой теплотой плавления. Это тепло заставляет атомы терять плотную и упорядоченное кристаллическую структуру. Этот процесс является обратимым, он работает в обоих направлениях – и при нагреве, и при охлаждении.
Равновесная температура плавления
Как было показано выше, чистые кристаллические вещества, например, чистые металлы, имеют характерную температуру плавления, которую часто называют «точкой плавления». При этой температуре это чистое твердое кристаллическое вещество плавится и становится жидкостью. Переход между твердым и жидким состоянием для малых образцов чистых металлов настолько мал, что может измеряться с точностью 0,1 ºС.
Жидкости имеют характерную температуру, при которой они превращаются в твердое вещество. Эту температуру называют температурой затвердевания или точкой затвердевания. Теоретически – в равновесных условиях – равновесная температура плавления твердого вещества является той же самой, что и равновесная температура его затвердевания. На практике можно наблюдать небольшие различия между этими величинами (рисунок 3).

Рисунок 3 – Кривые охлаждения и нагрева чистого металла.
Видны явления переохлаждения при охлаждении и перегрева при нагреве.
В начале затвердевания наблюдается впадина на кривой охлаждения,
что объясняется замедленным началом кристаллизации [4]
Температуры ликвидус и солидус
- Температура начала плавления называется температурой солидус (или точкой солидус)
- Температура окончания плавления – температурой ликвидус (или точкой ликвидус).
«Солидус» означает, понятно, твердый, а «ликвидус» – жидкий: при температуре солидуса весь сплав еще твердый , а при температуре ликвидуса – весь уже жидкий .
При затвердевании этого сплава из жидкого состояния температура начала кристаллизации (затвердевания) будет та же температурой ликвидус, а окончания кристаллизации – та же температура солидус. При температуре сплава между его температурами солидуса и ликвидуса он находится в полужидком-полутвердом, кашеобразном состоянии.
Плавление алюминия
Влияние легирующих элементов и примесей
Добавление в алюминий других элементов, в том числе легирующих, снижает температуру его плавления, точнее – начала его плавления. Так, у некоторых литейных алюминиевых сплавов с большим содержанием кремния и магния температура начала плавления снижается почти до 500 °С. Вообще, понятие «температура плавления» распространяется только на чистые металлы и другие кристаллические вещества. У сплавов же нет определённой температуры плавления: процесс их плавления (и затвердевания) происходит в некотором интервале температур.

Рисунок 4- Изменение удельного объема чистого металла (алюминия) и
сплава этого металла (алюминиевого сплава) [4]
Интервалы температуры плавления
В таблице ниже представлены температуры ликвидуса и солидуса некоторых промышленных деформируемых сплавов. Необходимо иметь в виду, что понятия температур солидус и ликвидус определены для равновесных превращений жидкой фазы в твердую и обратно, то есть при бесконечной длительности процессов. На практике надо делать поправки с учетом скорости нагрева или охлаждения.
Плавление силумина
Не все сплавы имеют интервал между температурами солидус и ликвидус. Такие сплавы называют эвтектическим. Например, у алюминиевого сплава с содержанием 12,5 % кремния точки ликвидуса и солидуса сводятся в точку: этот сплав как и чистые металлы имеет не интервал, а точку плавления. Эта точка и температура называются эвтектическими. Этот сплав относится к знаменитым литейным алюминиево-кремниевым сплавам – силуминам с узким интервалом солидус-ликвидус, что и дает их лучшие литейные свойства.
В двойном сплаве Al-Si температура солидус постоянна и составляет 577 °С. При увеличении содержания кремния температура ликвидус снижается от максимального значения для чистого алюминия 660 °С и до совпадения с температурой солидуса 577 °С при содержании кремния 12,6 %.
Среди других легирующих элементов алюминия сильнее всего понижает температуру плавления магний: эвтектическая температура 450 °С достигается при содержании магния 18,9 %. Медь дает эвтектическую температуру 548 °С, а марганец – всего лишь 658 °С! Большинство сплавов являются не двойными, а тройными и даже четверными. Поэтому при совместном влиянии нескольких легирующих элементов температура солидуса – начала плавления или конца затвердевания может быть еще ниже.
Технология плавления алюминия в домашних условиях
Суть плавления состоит из нескольких этапов:
- Подготовка лома. В качестве исходного сырья используют профиль из алюминия, проволоку (ее предварительно уминают пассатижами), отслужившие детали. Кусочки должны быть небольшими. Краску, вкрапления других металлов из них не достают, все это будет в составе шлака.
- Подбор емкости, в которой можно плавить алюминий. Подойдет прочная посудина из стали (температура плавления 1300°С) или чугунок (1100°С), используют готовые огнеупорные тигли.
- Подготовка формы для расплава. В домашних условиях их делают самостоятельно. Процедура изготовления представлена ниже.
- Плавление лома. Предварительно определяют источник тепла.
- Снятие шлака, изготовление отливки. Самый простой способ плавки – аккуратно слить жидкий алюминий в подготовленную емкость или форму, шлак остается на стенках плавильной посудины. Чтобы он не прилип, требуется быстро ее охладить.
В принципе, технология промышленного и кустарного литья ничем не отличается. Лом плавят до состояния текучести. После этого отделяют расплав от шлака, сливают в заготовленные формы. Их после охлаждения отливки разбивают. Важно определить, что в результате должно получиться из жидкого алюминия. Даже если плавить металл решили ради эксперимента, емкость или форму для литья все равно необходимо приготовить. Тогда можно будет рассмотреть получившийся слиток, проверить его на пористость, чистоту, однородность структуры.
Оборудование и способы плавки
Прежде, чем плавить алюминий, выбирают место и способ разогрева металла. Два часто используемых варианта:
- В гаражах или домовладениях плавят алюминий, сооружается плавильня, ее составляют из кирпича без использования связующего раствора. В качестве опоры удобен металлический каркас, в нем должно быть отверстие для нагнетания воздуха, для этого используют пылесос или фен. Самодельная печь обкладывается углем. Емкость для плавления с ломом помещают внутрь. Для лучшего сохранения тепла кирпичи сверху накрывают листом металла.
- В домашних условиях для разогрева небольшого количества лома пользуются:
— газовой плитой, можно плавить небольшое количество лома, но выход расплава будет невысокий.
Литье плавят в стальной посуде. Для повышения скорости нагрева используют конструкцию из двух емкостей, их вставляют одна в другую с зазором 1 см. Дно большой посудины перфорируется, оно выполняет функцию пламярассекателя. Когда есть газовая горелка, совмещают нижний нагрев с верхним. Плавить металл можно быстрее.
Для небольших порций лома иногда используют жестяные банки. Но эта тара ненадежная, не исключено прогорание жести. Надежнее использовать керамический или металлический огнеупорный тигель для муфельных печей. Хороший вариант – обрезанный стакан огнетушителя. Для удобства делают желоб, по которому будет стекать расплавленный алюминий. При работе используют длинные щипцы. Понадобится ложка на длинной ручке для сбора шлака.
Как сделать форму для отливки
Перед тем, как расплавить алюминий, готовят болванку для отливки. Существует несколько способов заливки жидкого расплава. Чаще используют открытый и закрытый метод. О каждом стоит рассказать подробнее.
Открытая форма
Когда плавят алюминий по открытой методике, после плавления расплав выливают в подготовленную емкость, например, жестяную банку. Алюминиевую отливку вынимают из банки в горячем виде, когда горячий расплав немного схватится сверху. Достаточно несильно постучать по емкости. Если не нужен слиток заданной геометрии, расплавленный металл выливают на любую ровную огнеупорную поверхность, он хорошо держится, не растекается, внешне напоминает ртуть.
Закрытая форма
Сложные по геометрии отливки получают в специально приготовленных формах. Она должна соответствовать параметрам детали, обычно делается разъемной. Для изготовления формы используют деталь-макет, по которому делают отливку. В качестве формующего материала используют кремнезем, он хорошо трамбуется, его несложно найти. Кремнезем заменяют:
- смесью речного песка и жидкого стекла;
- смесь песка, цемента, вместо воды добавляют тормозную жидкость;
- гипс, он удобен для сложных макетов.
Из гипса делают сплошные бесшовные формы, они одноразовые, их после застывания алюминия разбивают. Деталь-макет изготавливают из воска или пенопласта. Его помещают внутрь емкости, используемой для формы, затем заливают пустоты. Получаются ровные детали, не требующие дополнительной обработки. Когда используется гипс, его сушат в течение пары дней. Гипс боится влаги, разбухает. Он склонен к растрескиванию при высыхании. При контакте с парафином или пенопластом гипс сохраняет свою структуру, не образуется рытвин, раковин.
Затвердевание алюминия
Чистый алюминий
Чистые металлы, в том числе, чистый алюминий, имеют четкую температуру плавления – точку плавления. Затвердевание или «замерзание» чистого алюминия происходит также при постоянной температуре. Когда чистый жидкий алюминий охлаждается, его температура падает до температуры затвердевания и остается при этой температуре, пока весь он (жидкий алюминий) не затвердеет. На рисунках 5 и 6 показаны типичные кривые охлаждения чистого металла с переходом его из жидкого состояния в твердое.

Рисунок 5 – Кривая охлаждения чистого металла (например, алюминия) [3]

Рисунок 6 – Затвердевание чистого алюминия [5]
Алюминиевый сплав
При затвердевании алюминиевого сплава, который состоит из алюминия и растворенного в нем легирующего элемента, например, кремния или меди, то кривая охлаждение этого сплава показывает, что начало затвердевания происходит при одной температуре, а окончание – при другой температуре (рисунок 7).

Рисунок 7 – Кривая охлаждения сплава (например, алюминиевого сплава) [3]
Расплавление алюминиевых сплавов для литья
Для нагрева алюминиевого сплава до температуры жидкого состояния, при которой возможно выполнение операций литья, применяют плавильные печи различных видов. Тепловая энергия, которая требуется для того, чтобы нагреть металл до температуры жидкого состояния, при которой его можно разливать в литейные формы, состоит из суммы следующих компонентов:
- Теплота, чтобы поднять температуру металла до температуры плавления
- Теплота плавления, чтобы перевести металл из твердого состояния в жидкое состояние
- Теплота для нагрева расплавленного металла до заданной температуры разливки
Температура разливки – это температура расплавленного металла, при которой он заливается в литейную форму. Важным фактором здесь является разность между температурой разливки и температурой, при которой начинается затвердевание. Этой температурой является температура (точка) плавления для чистого алюминия или температура ликвидус для алюминиевого сплава. Эту разность температур иногда называют перегревом. Этот термин также может применяться для количества теплоты, которое надо отобрать от жидкого металла между разливкой и моментом начала затвердевания.
Применение металла в промышленном производстве
В естественных условиях алюминий имеет свойство образовывать тонкую оксидную пленку, что предотвращает реакции с водой и азотной кислотой (без нагрева). При разрушении пленки в результате контакта со щелочами химический элемент выступает в качестве восстановителя.
С целью предотвращения образования оксидной пленки в сплав добавляют другие металлы (галлий, олово, индий). Металл практически не подвергается коррозионным процессам. Он является востребованным материалом в различных отраслях промышленности.
Олово

Олово (химический символ — Sn; лат. Stannum ) — элемент 14-й группы периодической системы химических элементов (по устаревшей классификации — элемент главной подгруппы IV группы), пятого периода, с атомным номером 50. Относится к группе лёгких металлов. При нормальных условиях простое вещество олово — пластичный, ковкий и легкоплавкий блестящий металл серебристо-белого цвета. Известны четыре аллотропические модификации олова: ниже +13,2 °C устойчиво α -олово (серое олово) с кубической решёткой типа алмаза, выше +13,2 °C устойчиво β -олово (белое олово) с тетрагональной кристаллической решёткой. При высоких давлениях обнаружены также γ -олово и σ -олово.
Содержание
- 1 История
- 2 Происхождение названия
- 3 Физические свойства
- 3.1 Серое и белое олово
- 3.2 Изотопы
- 4.1 Металлическое олово
- 4.2 Олово (II)
- 4.3 Олово (IV)
- 5.1 Месторождения
- 5.2 Распространённость в природе
- 5.3 Формы нахождения
- 5.3.1 Твёрдая фаза. Минералы
- 5.3.2 Собственно минеральные формы
- 5.3.2.1 Самородные элементы, сплавы и интерметаллические соединения
- 5.3.2.2 Окисные соединения олова
- 5.3.2.2.1 Касситерит
- 5.3.2.2.2 Гидроокисные соединения
- 5.3.2.2.3 Силикаты
- 5.3.2.2.4 Шпинелиды
- 5.3.2.3.1 Станнин
История
Олово было известно человеку уже в IV тысячелетии до н. э. Этот металл был малодоступен и дорог, поэтому изделия из него редко встречаются среди римских и греческих древностей. Об олове есть упоминания в Библии, Четвёртой Книге Моисея. Олово является (наряду с медью) одним из компонентов оловяннистой бронзы, изобретённой в конце или середине III тысячелетия до н. э. Поскольку бронза являлась наиболее прочным из известных в то время металлов и сплавов, олово было «стратегическим металлом» в течение всего «бронзового века», более 2000 лет (очень приблизительно: XXXV—XI века до н. э.).
Чистое олово получено не ранее XII в., о нем упоминает в своих трудах Р. Бэкон. До этого олово всегда содержало переменное количество свинца. Хлорид SnCl4 впервые получил А. Либавий в 1597 г. Аллотропию олова и явление «оловянной чумы» объяснил Э. Кохен в 1899 г.
Происхождение названия
Латинское название stannum , связанное с санскритским словом, означающим «стойкий, прочный», первоначально относилось к сплаву свинца и серебра, а позднее к другому, имитирующему его сплаву, содержащему около 67 % олова; к IV веку н. э. этим словом стали называть собственно олово.
Слово олово — общеславянское, однако в некоторых славянских языках такое же или однокоренное слово (польск. ołów , чеш. olovo , серб. олово и др.) используется для обозначения другого, внешне похожего металла — свинца. Слово олово имеет соответствия в балтийских языках (ср. лит. alavas, alvas , латыш. alva — «олово», прусск. alwis — «свинец»). Оно является суффиксальным образованием от корня ol- (ср. древневерхненемецкое elo — «жёлтый», лат. albus — «белый» и пр.), так что металл назван по цвету.
Физические свойства
Механические и технологические свойства:
модуль упругости 55 ГПа при 0 °С и 48 ГПа при 100 °С; модуль сдвига 16,8—8,1 ГПа; временное сопротивление разрыву — 20 МПа; относительное удлинение — 40 %; твёрдость по Бринеллю — 152 МПа (белое олово), 62 МПа (серое олово); температура литья — 260—300 °С.
При температуре немного выше 170 °С олово становится хрупким.
Стандартный электродный потенциал E °Sn 2+ /Sn равен −0,136 В, а E пары °Sn 4+ /Sn 2+ около 0,151 В.
Серое и белое олово

Простое вещество олово полиморфно. В обычных условиях оно существует в виде β -модификации (белое олово), устойчивой выше +13,2 °C. Белое олово — серебристо-белый, мягкий, пластичный металл, образующий кристаллы тетрагональной сингонии, пространственная группа I4/amd, параметры ячейки a = 0,58197 нм , c = 0,3175 нм , Z = 4 . Координационное окружение каждого атома олова в нём — октаэдр. Плотность β -Sn равна 7,228 г/см 3 . При сгибании прутков олова слышен характерный хруст от взаимного трения кристаллитов.
При охлаждении белое олово переходит в α -модификацию (серое олово). Серое олово образует кристаллы кубической сингонии, пространственная группа Fd3m, параметры ячейки a = 0,646 нм , Z = 8 со структурой типа алмаза. В сером олове координационный полиэдр каждого атома — тетраэдр, координационное число 4. Фазовый переход β -Sn в α -Sn сопровождается увеличением удельного объёма на 25,6 % (плотность α -Sn составляет 5,75 г/см 3 ), что приводит к рассыпанию олова в порошок. Энтальпия перехода α → β ΔH = 2,08 кДж/моль . Одна модификация переходит в другую тем быстрее, чем ниже температура окружающей среды. При −33 °C скорость превращений становится максимальной. Тем не менее белое олово можно переохладить до гелиевых температур. Белое олово превращается в серое также под действием ионизирующего излучения.
Из-за сильного различия структур двух модификаций олова разнятся и их электрофизические свойства. Так, β -Sn — металл, а α -Sn относится к числу полупроводников. Ниже 3,72 К α -Sn переходит в сверхпроводящее состояние. Атомы в кристаллической решётке белого олова находятся в электронном s 2 p 2 -состоянии. Серое олово — ковалентный кристалл со структурой алмаза и электронным sp 3 -состоянием. Белое олово слабо парамагнитно, атомная магнитная восприимчивость χ = +4,5·10 −6 (при 303 К ), при температуре плавления становится диамагнитным, χ = −5,1·10 −6 . Серое олово диамагнитно, χ = −3,7·10 −5 (при 293 К ).
Соприкосновение серого олова и белого приводит к «заражению» последнего, то есть к ускорению фазового перехода по сравнению со спонтанным процессом из-за появления зародышей новой кристаллической фазы. Совокупность этих явлений называется «оловянной чумой». Нынешнее название этому процессу в 1911 году дал Г. Коэн. Начало научного изучения этого фазового перехода было положено в 1870 году работами петербургского учёного, академика Ю. Фрицше. Много ценных наблюдений и мыслей об этом процессе высказано Д. И. Менделеевым в его «Основах химии».
Одним из средств предотвращения «оловянной чумы» является добавление в олово стабилизатора, например висмута. С другой стороны, ускоряет процесс перехода белого олова в серое при не очень низких температурах катализатор хлорстаннат аммония (NH4)2SnCl6.
«Оловянная чума» — одна из причин гибели экспедиции Скотта к Южному полюсу в 1912 году. Она осталась без горючего из-за того, что топливо просочилось из запаянных оловом баков, поражённых «оловянной чумой».
Некоторые историки указывают на «оловянную чуму» как на одно из обстоятельств поражения армии Наполеона в России в 1812 году — сильные морозы привели к превращению оловянных пуговиц на мундирах солдат в порошок.
«Оловянная чума» погубила многие коллекции оловянных солдатиков. Например, в запасниках петербургского музея Александра Суворова превратились в труху десятки фигурок — в подвале, где они хранились, лопнули зимой батареи отопления.
При высоких давлениях обнаружены ещё две модификации олова: γ -олово (переход при температуре 161 °C и давлении около 4 ГПа, при комнатной температуре и давлении 10 ГПа) и σ -олово (переход при температуре около 1000 °C и давлении выше 21 ГПа).

Изотопы
Природное олово состоит из десяти стабильных нуклидов с массовыми числами 112 (в смеси 0,96 % по массе), 114 (0,66 %), 115 (0,35 %), 116 (14,30 %), 117 (7,61 %), 118 (24,03 %), 119 (8,58 %), 120 (32,85 %), 122 (4,72 %) и 124 (5,94 %). Для некоторых из них энергетически возможен двойной бета-распад, однако экспериментально он пока (2018 г.) не наблюдался, поскольку предсказываемый период полураспада очень велик (более 10 20 лет).
Олово обладает наибольшим среди всех элементов числом стабильных изотопов, что связано с тем, что 50 (число протонов в ядрах олова) является магическим числом — оно составляет заполненную протонную оболочку в ядре и повышает тем самым энергию связи и стабильность ядра. Известны два дважды магических изотопа олова, оба они радиоактивны, так как удалены от полосы бета-стабильности: нейтронодефицитное 100 Sn ( Z = N = 50 ) и нейтроноизбыточное 132 Sn ( Z = 50 , N = 82 ).
Изотопы олова 117 Sn и 119 Sn являются мёссбауэровскими изотопами и применяются в гамма-резонансной спектроскопии.
Химические свойства
Металлическое олово
При комнатной температуре олово, подобно соседу по группе германию, устойчиво к воздействию воздуха или воды. Такая инертность объясняется образованием поверхностной плёнки оксидов. Заметное окисление олова на воздухе начинается при температурах выше 150 °C:
При нагревании олово реагирует с большинством неметаллов. При этом образуются соединения в степени окисления +4, которая более характерна для олова, чем +2. Например:
Растворяется в разбавленных кислотах (HCl, H2SO4):
Олово реагирует c концентрированной соляной кислотой. При этом белое олово (α-Sn) образует раствор хлорида олова (II), а серое (β-Sn) хлорида олова (IV):
Состав продукта реакции олова с азотной кислотой зависит от концентрации кислоты. В концентрированной азотной кислоте (60%) образуется оловянная кислота β -SnO2· n H2O (иногда её формулу записывают как H2SnO3). При этом олово ведёт себя как неметалл:
При взаимодействии с разбавленной азотной кислотой (3-5%) образуется нитрат олова (II):
Окисляется растворами щелочей до гидроксостанната (II), который в горячих расстворах склонен к диспропорцианированию:
Sn + NaOH + 3H2O → Na[Sn(OH)3] + H2↑ 2Na[Sn(OH)3] → Sn + Na2[Sn(OH)6] Sn + 2NaOH + 4H2O → Na2[Sn(OH)6] + 2H2↑

Олово (II)
Менее устойчивая степень окисления чем (IV). Вещества имеют высокую восстановительную активность и легко диспропорцианируют:
2SnO → to SnO2 + Sn
На воздухе соединения быстро окисляются кислородом, как в твердом виде, так и в растворах:
2SnO + O2 → 2SnO2 2Sn 2+ + O2 + 4H + → 2Sn 4+ + 2H2O
Сильным восстановителем является «оловянная соль» SnCl2 ⋅ 2H2O
Оксид можно получить действием аммиака на горячий раствор хлорида олова в атмосфере СO2:
Также при слабом нагревании гидроксида олова (II) Sn(OH)2 в вакууме или осторожном нагревании некоторых солей:
В растворах солей олова идёт сильный гидролиз:
При действии на раствор соли Sn(II) растворами сульфидов выпадает осадок сульфида олова (II):
Этот сульфид может быть легко окислен до сульфидного комплекса раствором полисульфида натрия, при подкислении превращающегося в осадок сульфида олова (IV):
Олово (IV)
Оксид олова(IV) (SnO2) образуется прямым окислением кислородом. При сплавлении с щелочами образует станнаты, при обработке водой образующие гидроксостаннаты:
При гидролизе растворов солей олова (IV) образуется белый осадок — так называемая α -оловянная кислота:
Свежеполученная α -оловянная кислота растворяется в кислотах и щелочах:
При хранении α -оловянная кислота стареет, теряет воду и переходит в β -оловянную кислоту, которая отличается большей химической инертностью. Данное изменение свойств связывают с уменьшением числа активных HO-Sn группировок при стоянии и замене их на более инертные мостиковые -Sn-O-Sn- связи.
Гидрид олова — станнан SnH4 — можно получить по реакции:
Этот гидрид весьма нестоек и медленно разлагается уже при температуре 0 °C.
Четырёхвалентное олово образует обширный класс оловоорганических соединений, используемых в органическом синтезе, в качестве пестицидов и др.
Нахождение в природе
Олово — редкий рассеянный элемент, по распространённости в земной коре олово занимает 47-е место. Кларковое содержание олова в земной коре составляет, по разным данным, от 2⋅10 −4 до 8⋅10 −3 % по массе. Основной минерал олова — касситерит (оловянный камень) SnO2, содержащий до 78,8 % олова. Гораздо реже в природе встречается станнин (оловянный колчедан) — Cu2FeSnS4 (27,5 % Sn).
Месторождения
Мировые месторождения олова находятся в основном в Китае и Юго-Восточной Азии — Индонезии, Малайзии и Таиланде. Также есть крупные месторождения в Южной Америке (Боливии, Перу, Бразилии) и Австралии.
В России запасы оловянных руд расположены в Хабаровском крае (Солнечный район — месторождения Фестивальное и Соболиное; Верхнебуреинский район — Правоурмийское месторождение), в Чукотском автономном округе (Пыркакайские штокверки; рудник/посёлок Валькумей, Иультин — разработка месторождений закрыта в начале 1990-х годов), в Приморском крае (Кавалеровский район), в Якутии (месторождение Депутатское) и других районах.
Распространённость в природе
Распространённость в природе отражена в следующей таблице:
Геол. объект Камен. метеориты Дуниты и др. Базальты и др. Диориты и др. Гранитоиды Глины и др. Вода океанов Живое вещество(% на живой вес) Почва Зола растений Содержание, вес. % 00 1⋅10 −4 0 5⋅10 −5 0 1,5⋅10 −4 0000 − 000 3⋅10 −4 1⋅10 −3 0 7⋅10 −7 0000 5⋅10 −5 1⋅10 −3 00 5⋅10 −4 В незагрязнённых поверхностных водах олово содержится в субмикрограммовых концентрациях. В подземных водах его концентрация достигает единиц микрограмм на литр, увеличиваясь в районе оловорудных месторождений, оно попадает в воды за счёт разрушения в первую очередь сульфидных минералов, неустойчивых в зоне окисления. ПДКSn = 2 мг/дм³ .

Олово является амфотерным элементом, то есть элементом, способным проявлять кислотные и основные свойства. Это свойство олова определяет и особенности его распространения в природе. Благодаря этой двойственности олово проявляет литофильные, халькофильные и сидерофильные свойства. Олово по своим свойствам проявляет близость к кварцу, вследствие чего известна тесная связь олова в виде окиси (касситерита) с кислыми гранитоидами (литофильность), часто обогащёнными оловом, вплоть до образования самостоятельных кварц-касситеритовых жил. Щелочной характер поведения олова определяется в образовании довольно разнообразных сульфидных соединений (халькофильность), вплоть до образования самородного олова и различных интерметаллических соединений, известных в ультраосновных породах (сидерофильность).
Формы нахождения
Основная форма нахождения олова в горных породах и минералах — рассеянная (или эндокриптная). Однако олово образует и минеральные формы, и в этом виде часто встречается не только как акцессорий в кислых магматических породах, но и образует промышленные концентрации преимущественно в окисной (касситерит SnO2) и сульфидной (станнин) формах.
Твёрдая фаза. Минералы

В общем можно выделить следующие формы нахождения олова в природе:
- Рассеянная форма; конкретная форма нахождения олова в этом виде неизвестна. Здесь можно говорить об изоморфно рассеянной форме нахождения олова вследствие наличия изоморфизма с рядом элементов (Ta, Nb, W — с образованием типично кислородных соединений; V, Cr, Ti, Mn, Sc — с образованием кислородных и сульфидных соединений). Если концентрации олова не превышают некоторых критических значений, то оно изоморфно может замещать названные элементы. Механизмы изоморфизма различны.
- Минеральная форма: олово установлено в минералах-концентраторах. Как правило, это минералы, в которых присутствует железо Fe +2 : биотиты, гранаты, пироксены, магнетиты, турмалины и так далее. Эта связь обусловлена изоморфизмом, например, по схеме Sn +4 + Fe +2 → 2Fe +3 . В оловоносных скарнах высокие концентрации олова установлены в гранатах (до 5,8 вес. %) (особенно в андрадитах), эпидотах (до 2,84 вес. %) и так далее.
На сульфидных месторождениях олово входит как изоморфный элемент в сфалериты (Силинское месторождение, Россия, Приморье), халькопириты (Дубровское месторождение, Россия, Приморье), пириты. Высокие концентрации олова выявлены в пирротине грейзенов Смирновского месторождения (Россия, Приморье). Считается, что из-за ограниченного изоморфизма происходит распад твёрдых растворов с микровыделениями Cu2 +1 Fe +2 SnS4 или тиллита PbSnS2 и других минералов.
Собственно минеральные формы
Самородные элементы, сплавы и интерметаллические соединения
Хотя концентрации этих минералов в породах очень низки, однако распространены они в широком круге генетических образований. Среди самородных форм вместе с Sn выявлены Fe, Al, Cu, Ti, Cd и так далее, не считая уже известные самородные платиноиды, золото и серебро. Эти же элементы образуют между собой и различные сплавы: (Cu + Sn + Sb), (Pb + Sn + Sb) и другие, а также твёрдые растворы. Среди интерметаллических соединений установлены стистаит SnSb, атакит (Pd,Pt)3Sn, штумырлит Pt(Sn,Bi), звягинцевит (Pd,Pt)3(Pb,Sn), таймырит (Pd,Cu,Pt)3Sn и другие.
Приведённые формы нахождения олова и других элементов встречаются в различных геологических образованиях:
- Группа интрузивных и эффузивных магматических пород: траппы, пикриты Сибирской платформы, гипербазиты и габброиды Камчатки, кимберлиты Якутии, лампроиты Алдана и так далее; гранитоиды Приморья, Дальнего Востока, Тянь-Шаня.
- Группа метасоматически и гидротермально изменённых пород: медно-никелевые руды Сибирской платформы, золоторудные объекты Урала, Кавказа, Узбекистана и так далее.
- Группа современного рудообразования: пелагические осадки Тихого океана, продукты Большого Трещинного Толбачинского извержения, гидротермальная система Узон на Камчатке и прочие.
- Группа осадочных пород различного происхождения.
Окисные соединения олова
Наиболее известной формой является главный минерал олова — касситерит SnO2, представляющий собой соединение олова с кислородом. В минерале по данным ядерной гамма-резонансной спектроскопии присутствует Sn +4 .
Касситерит
Касситерит (от греч. kassiteros — олово) — главный рудный минерал для получения олова, химическая формула SnO2. Теоретически содержит 78,62 % Sn. Образует отдельные выделения, зерна, сплошные массивные агрегаты, в которых зёрна минерала достигают в размере 3—4 мм и даже больше. В чистом виде бесцветные кристаллы, примеси придают минералу самые различные цвета.
- Плотность 6040—7120 кг/м³ (наиболее низкая у светлоокрашенных касситеритов).
- Твёрдость по Моосу 6,5.
- Блеск — матовый, на гранях — алмазный.
- Спайность несовершенная.
- Излом раковистый.
Основные формы выделения касситерита:
- микровключения в других минералах;
- акцессорные выделения минерала в породах и рудах;
- сплошные или вкрапленные руды: игольчатые радиально-лучистые агрегаты (месторождения Приморья), коломорфные и криптокристаллические выделения и скопления (месторождения Приморья); кристаллическая форма — главная форма выделения касситерита.
В России месторождения касситерита имеются на Северо-Востоке, в Приморье, Якутии, Забайкалье; за рубежом — в Малайзии, Таиланде, Индонезии, КНР, Боливии, Нигерии и других странах.
Гидроокисные соединения
Второстепенное место занимают гидроокисные соединения олова, которые можно рассматривать как соли полиоловянных кислот. К ним можно отнести минерал сукулаит Ta2Sn2 +2 O; твёрдый раствор олова в магнетите вида Fe2SnO4 или Fe3SnO3 (Бретштейн Ю. С., 1974; Воронина Л. Б., 1979); «варламовит» — продукт окисления станнина; считается, что он представляет собой смесь аморфных и полуаморфных соединений Sn, метаоловянной кислоты, поликонденсированной фазы и гидрокасситеритовой фазы. Известны также гидратированные продукты окисления — гидромартит 3SnO·H2O; мушистонит (Cu,Zn,Fe)Sn(OH)6; гидростаннат меди CuSn(OH)6 и другие.
Силикаты
Известна многочисленная группа силикатов олова, представленная малаяитом CaSn[SiO5]; пабститом Ba(Sn, Ti)Si3O9, стоказитом Ca2Sn2Si6O18·4H2O и др. Малаяит образует даже промышленные скопления.
Шпинелиды
Из других окисных соединений известны также шпинелиды, например, минерал нигерит Sn2Fe4Al16O32 (Peterson E. U., 1986).
Сульфидные соединения олова
Включает различные соединения олова с серой. Это вторая по промышленному значению группа минеральных форм нахождения олова. Наиболее важным из них является станнин, второй по значению минерал. Кроме этого, отмечаются франкеит Pb5Sn3Sb2S14, герценбергит SnS, берндтит SnS2, тиллит PbSnS2 и кестерит Cu2ZnSnS4. Выявлены и более сложные сульфидные соединения олова со свинцом, серебром, медью, имеющие в основном минералогическое значение. Тесная связь олова с медью обусловливает частое присутствие на оловорудных месторождениях халькопирита CuFeS2 с образованием парагенезиса касситерит — халькопирит.
Станнин
Станнин (от лат. stannum — олово), оловянный колчедан, минерал из класса сульфидов с общей формулой вида Cu2FeSnS4. Она следует из формулы халькопирита путём замены одного атома Fe на Sn. Содержит 29,58 % Cu, 12,99 % Fe, 27,5 % Sn и 29,8 S, а также примеси Zn, Sb, Cd, Pb и Ag. Широко распространённый минерал в оловорудных месторождениях России. На ряде месторождений России (Приморье, Якутия) и Средней Азии (Таджикистан) он является существенным элементов сульфидных минералов и часто вместе с варламовитом составляет 10—40 % общего олова. Часто образует вкрапленность в сфалерите ZnS, халькопирите. Во многих случаях наблюдаются явления распада станнина с выделением касситерита.
Коллоидная форма
Коллоидные и олово-кремнистые соединения играют значительную роль в геохимии олова, хотя детально она не изучена. Значительное место в геологии элемента играют коломорфные соединения и продукты его кристаллических превращений в скрытокристаллические разности. Коломорфный касситерит рассматривается как форма выражения вязких гелеобразных растворов.
Независимые исследования выявили аномально высокую растворимость SnO2 в хлор-кремниевых растворах. Максимальная растворимость достигается при отношении SnO2SiO2 = 1,5 .
Анализ свойств соединения Sn(OH)4 и близость их к соединению Si(OH)4 выявляет способность его к полимеризации с образованием в конечном счёте соединений H2Sn k O2 k +1, Sn k O2 k −1(OH)2. В обоих случаях возможно замещение группы (ОН) на анионы F и Cl.
Таким образом, полимеризация молекул Sn(OH)4 и соединение их с молекулами Si(OH)4 ведёт к образованию геля (коллоида) и появлению цепочек H m Sn2 n Si n O p , причём m ≤ 8 , или H s [SiO2 n (SnO m ) d ] (Некрасов И. Я. и др., 1973).
Имеющиеся данные говорят о том, что коллоидная форма является естественным промежуточным звеном при осаждении олова из гидротермальных растворов.
Формы нахождения олова в жидкой фазе
Наименее изученная часть геохимии олова, хотя в газово-жидких включениях установлены касситериты в виде минералов-узников (Кокорин А. М. и др., 1975). Работ по анализу конкретных оловосодержащих природных растворов нет. В основном вся информация основана на результатах экспериментальных исследований, которые говорят только о вероятных формах нахождения олова в растворах. Существенную роль в разработке методики этих исследований принадлежит академику В. Л. Барсукову.
Вся совокупность экспериментально установленных форм нахождения олова в растворах разбивается на группы:
- Ионные соединения. Эти соединения и их структура описываются с позиций классических валентных и стереохимических представлений. Выделяются подгруппы:
- Простые ионы Sn +2 и Sn +4 в основном обнаружены в магматических расплавах, а также в гидротермальных растворах, обладающих низкими значениями pH. Однако в существующих гидротермальных системах, отражаемых составом газово-жидких включений, такие условия не установлены.
- Галогениды — SnF2, SnF4 0 , SnCl4 0 . Считается, что роль хлора в переносе и отложении олова и сопутствующих металлов более значительна, чем роль фтора.
- Гидроксильные соединения. В щелочных условиях исходными являются соединения H2SnO2, H2SnO4, H2SnO3. Эти формы часто устанавливаются на основе известных минеральных форм. Часть этих форм имеет как искусственное (CaSnO3, Ca2SnO4), так и природное (FeSnO2, Fe2SnO4) происхождение. В кислых средах эти соединения ведут себя как слабые основания типа Sn(OH)2, Sn(OH)4. Считается, что одной из форм проявления подобных соединений является варламовит. Согласно экспериментальным данным Sn(OH)4 отлагается только при Т < 280 °C в слабокислых или нейтральных условиях при pH = 7—9 . Соединения Sn(OH)4 и Sn(OH)3 + устойчивы при pH= 7—9, тогда как Sn(OH)2 +2 и Sn(OH) +2 — при pH < 7 . Довольно часто группы (ОН) −1 замещаются на F и Cl, создавая галогенозамещённые модификации гидросоединений олова. В общем виде эти формы представлены соединениями Sn(OH)4- kF k или Sn(OH)4− kF k-nCl n. В целом соединение Sn(OH)3F устойчиво при Т = +25…+50 °C , а Sn(OH)2F2 — при Т = 200 °C .
- Сульфидные соединения. По экспериментальным данным в растворе присутствуют соединения SnS4 −4 или SnS3 −2 при pH > 9 ; SnS2O −2 ( pH = 8—9 ) и Sn(SH)4 ( pH = 6 ). Имеется упоминание о существовании соединения типа Na2SnS3, неустойчивого в кислой среде.
Промышленные типы месторождений олова
Описанные выше геохимические особенности олова находят косвенное отражение в формационной классификации оловорудных месторождений, предложенной Е. А. Радкевич с последующими дополнениями.
А. Формация оловоносных гранитов. Касситерит установлен в акцессорной части гранитов. Б. Формация редкометальных гранитов. Это граниты литионит-амазонит-альбитового типа (апограниты по А. А. Беусу). Касситерит в акцессорной части вместе колумбит-татнатлитом, микролитом и прочими. В. Формация оловоносных пегматитов. Оловянная минерализация характерна для Be-Li-, Be-Ta-, F-Li- типов. Г. Формация полевошпат-кварц-касситеритовая. Выделена Ив. Ф. Григорьевым. Это кварц-полевошпатовые жилы с касситеритом и другими минералами. Д. Формация кварц-касситеритовая. Распространена на северо-востоке России. Это жильные зоны, грейзены с кварцем, мусковитом, вольфрамитом, касситеритом и другим. Е. Формация касситерит-силикатно-сульфидная с турмалиновым и хлоритовым типами. Одна из основных продуктивных формаций Приморья России. Ж. Формация касситерит-сульфидная. Также основная оловопродуктивная формация. В ней выделяют основные типы: 1) штокверковое олово-вольфрамовое оруденение; 2) рудные тела квар-касситерит-арсенопиритового типа; 3) продуктивные кварцевые жилы сульфидно-касситерит-хлоритового типа. З. Формация оловянно-скарновая. И. Формация деревянистого олова (риолитовая формация). К. Формация основных и ультраосновных пород (по И. Я. Некрасову). Л. Формация щелочных пород Украины (по В. С. Металлиди, 1988).
Производство
В процессе производства рудоносная порода (касситерит) подвергается дроблению до размеров частиц в среднем
10 мм , в промышленных мельницах, после чего касситерит за счет своей относительно высокой плотности и массы отделяется от пустой породы вибрационно-гравитационным методом на обогатительных столах. В дополнение применяется флотационный метод обогащения/очистки руды. Таким образом удается повысить содержание олова в руде до 40—70 %. Далее проводят обжиг концентрата в кислороде для удаления примесей серы и мышьяка. Полученный концентрат оловянной руды выплавляется в печах. В процессе выплавки восстанавливается до свободного состояния посредством применения в восстановлении древесного угля, слои которого укладываются поочередно со слоями руды, или алюминием (цинком) в электропечах: SnO2 + C = Sn + CO2 . Особо чистое олово полупроводниковой чистоты готовят электрохимическим рафинированием или методом зонной плавки.
Применение
- Олово используется в основном как безопасное, нетоксичное, коррозионностойкое покрытие в чистом виде или в сплавах с другими металлами. Главные промышленные применения олова — в белой жести (лужёное железо) для изготовления тары пищевых продуктов, в припоях для электроники, в домовых трубопроводах, в подшипниковых сплавах и в покрытиях из олова и его сплавов. Важнейший сплав олова — бронза (с медью). Другой известный сплав — пьютер — используется для изготовления посуды. Для этих целей расходуется около 33 % всего добываемого олова. До 60 % производимого олова используется в виде сплавов с медью, медью и цинком, медью и сурьмой (подшипниковый сплав, или баббит), с цинком (упаковочная фольга) и в виде оловянно-свинцовых и оловянно-цинковых припоев. В последнее время возрождается интерес к использованию металла, поскольку он наиболее «экологичен» среди тяжёлых цветных металлов. Используется для создания сверхпроводящих проводов на основе интерметаллического соединения Nb3Sn.
- Дисульфид олова SnS2 применяют в составе красок, имитирующих позолоту («поталь»).
- Искусственные радиоактивные ядерные изомеры олова 117m Sn и 119m Sn — источники гамма-излучения, являются мёссбауэровскими изотопами и применяются в гамма-резонансной спектроскопии.
- Интерметаллические соединения олова и циркония обладают высокими температурами плавления (до 2000 °C) и стойкостью к окислению при нагревании на воздухе и имеют ряд областей применения.
- Олово является важнейшим легирующим компонентом при получении конструкционных сплавов титана.
- Двуокись олова — очень эффективный абразивный материал, применяемый при «доводке» поверхности оптического стекла.
- Смесь солей олова — «жёлтая композиция» — ранее использовалась как краситель для шерсти.
- Олово применяется также в химических источниках тока в качестве анодного материала, например: марганцево-оловянный элемент, окисно-ртутно-оловянный элемент. Перспективно использование олова в свинцово-оловянном аккумуляторе; так, например, при равном напряжении, по сравнению со свинцовым аккумулятором свинцово-оловянный аккумулятор обладает в 2,5 раза большей ёмкостью и в 5 раз большей энергоплотностью на единицу объёма, внутреннее сопротивление его значительно ниже.
- Исследуются изолированные двумерные слои олова (станен), созданные по аналогии с графеном.
Физиологическое действие
О роли олова в живых организмах практически ничего не известно. Ежедневное поступление олова с пищей составляет 0,2—3,5 мг , при регулярном потреблении консервированной пищи — до 38 мг . В теле человека содержится примерно (1—2)·10 −4 % олова, наибольшая концентрация наблюдается в кишечнике.
Металлическое олово не токсично, что позволяет применять его в пищевой промышленности. Олово представляет опасность для человека в виде паров, различных аэрозольных частиц и пыли. При воздействии паров или пыли олова может развиться станноз — поражение лёгких. Станнан (оловянистый водород) — сильнейший яд. Также очень токсичны некоторые оловоорганические соединения. Временно допустимая концентрация соединений олова в атмосферном воздухе 0,05 мг/м 3 , ПДК олова в пищевых продуктах 200 мг/кг , в молочных продуктах и соках — 100 мг/кг . Токсическая доза олова для человека — 2 г , интоксикация организма начинается при содержании в организме 250 мг/кг .
Вредные примеси, содержащиеся в олове в обычных условиях хранения и применения, в том числе в расплаве при температуре до 600 °C, не выделяются в воздух в объёмах, превышающих предельно допустимую концентрацию (в частности, определенную по ГОСТ 12.1.005—76. Длительное (в течение 15—20 лет ) воздействие пыли олова оказывает фиброгенное воздействие на лёгкие и может вызвать заболевание работающих пневмокониозом.
Источник https://tutsvarka.ru/vidy/marki-stali-vidy-i-klassifikatsiya-stalej-po-gost
Источник https://nashampure.ru/obrabotka-metalla/plavka/uchimsya-plavit-allyuminij
Источник https://chem.ru/olovo.html

