Содержание
Металлы. Их разновидности и свойства


Металлы , на сегодняшний день, являются одними из самых широко используемых материалов в мире. Металлами называют соединения с закономерным расположением атомов в узлах пространственной кристаллической решётки, которая обладает характерным блеском, способностью проводить тепло и электрический ток, а также отражать световые лучи. Для металлов характерны такие свойства как плотность, прочность, выносливость, свариваемость, пластичность, электропроводность, возможность создания различных сплавов.
Наличие данных свойств и характеризует, так называемое, металлическое состояние вещества. Такими свойствами обладают 75% всех элементов в периодической системе Менделеева. Неметаллы же не обладают вышеперечисленными свойствами и значительно отличаются по структуре, физическим и химическим свойствам от металлов.
Можно сказать, что металлы являются отличными проводниками электрического тока. Их свойства полностью диктует их кристаллическое строение и атомарный состав. Вследствие воздействия высокой температуры металлы частично снижают показатель своей электропроводности. В условиях же низкотемпературного режима электропроводность определенных видов металла возрастает, поэтому такие виды считаются сверхпроводниками. Дело в том, что в атомах металлов, прочно связанных в кристаллическую решетку, электроны могут легко передвигаться по всему объему, а не только на внешних слоях атома.

Сплавы — это вещества, состоящие из двух и более металлов, которые получаются с помощью плавления простых элементов. По числу компонентов сплавы делятся на двухкомпонентные (двойные), трехкомпонентные (тройные) и многокомпонентные. Компонент, который содержится в сплаве больше всего, называется основным, а компонент, вводимый в сплав для наделения ему нужных свойств – легирующим. В целом, совокупность компонентов сплава можно назвать системой. Изменяя компоненты и их пропорции, получают множество всевозможных сплавов с разнообразными физическими, механическими или химическими свойствами. Сплавы тоже располагают всеми характерными свойствами металлов, однако качественные характеристики их обычно заметно отличаются от самородков. Так, например, сплав, содержащий 40% кадмия и 60% висмута, имеет температуру плавления 144ºС, а температура плавления составляющих его компонентов – соответственно 321ºС и 271ºС, т. е. намного выше. Огромное преимущество сплавов заключается в том, что они превосходят чистые металлы по прочности, твердости, износостойкости и жаропрочности. Поэтому сплавы применяются значительно шире чистых металлов.
Классификация металлов и сплавов
Отличие металлов от сплавов заключается в различных визуальных признаках, такие как зернистость и гладкость поверхности. Также сплавы обладают теплопроводностью и электропроводностью.
Наиболее широкое распространение в промышленности получили медные, титановые, бронзовые и алюминиевые сплавы. Данные элементы служат сырьем для производства различных деталей и выливания металлоконструкций.
Классифицировать образцы металлов можно и более детально, взяв во внимание их целевое применение, сферы использования и принципы работы.
Существует также классификация металлов в соответствии с ГОСТом.
Каждый из стандартов определяет требования к металлическим материалам, к их индивидуальным характеристикам и сферам использования. Данные критерии становятся основными при выборе материала для определенной цели.

Дерево классификаций металлов
Группы металлов
Все металлы можно разделить на две группы, которые не только их имеют схожесть по свойствам, но и по промышленному применению. Такими группами являются черные и цветные металлы.
Черные металлы получили свое название из-за цвета, который меняется от темно-серого практически до белого. Они обладают значительной плотностью, высокой температурой плавления и твердостью. Самым распространенным и наиболее часто применяемым в промышленности представителем черных металлов является железо.
Цветные металлы также названы благодаря цвету простых веществ. Их цвет может быть красным, желтым, белым. Цветным металлам свойственны также уникальные физические и химические свойства. Они пластичны, мягки и легкоплавки по сравнению с черными металлами.

Класс черных металлов включает два подвида – сталь и чугун. Стали могут быть углеродистыми или легированными.
Различные виды черных сплавов получили значительное распространение в области изготовления металлопроката. Они обладают отличными рабочими свойствами, поэтому на рынке черные металлы всегда востребованы.
Добыча материалов происходит из железной руды, а с помощью доменной печи, где при температуре около 2000 градусов протекает процесс плавка руды, получают железо. По сути, способов выработки железа множество. Также помимо доменного процесса получения железа, существует способ прямого получения железа из предварительно измельченной железной руды с добавлением специальной глины. При этом способе железо получается в твердом виде, которое впоследствии переплавляется в мощных электрических печах.
Кроме видов металлов и их сплавов, существуют также и различные марки, разновидность которых указывается в буквенно-цифровом виде, например Ст3. Группировка марок черного металла используемая в металлопрокате, значительно облегчает поиск того или иного вида черного металла для различных сфер жизнедеятельности человека.
Любой металлопрокат по форме, размерам и предельным отклонениям должен строго соответствовать требованиям ГОСТ. К черному металлу относятся следующие виды проката: листовой, сортовый, фасонный, трубный. Как уже известно, к черным металлам относится чугун и сталь, которые, по сути, очень схожи за исключением количества содержащегося углерода.
Чугуны — сплавы содержащие углерод более 2,14 % (в некоторых чугунах до 6 %).
Стали — сплавы железа с углеродом при содержании углерода менее 2,14 %. Стали также бывают низкоуглеродистые (содержание углерода менее 0,25%), углеродистые (0,25 — 0,6 %), высокоуглеродистые (более 0,6 %). Низкоуглеродистые стали легко свариваемы и весьма пластичны, высокоуглеродистые же напротив – очень твердые, благодаря чему применяются в агрегатах режущих инструментов.
Кроме углерода в чугунах и сталях содержатся другие компоненты, такие как кремний, марганец, сера, фосфор.

Свое название данная группа металлов и сплавов получила, благодаря своим цветовым характеристикам. Например, медь – красного цвета, и ее сплавы имеют красноватый оттенок.
Сплавы получаются в результате смешивания металлов в различных пропорциях., от чего появляется новый продукт, обладающий улучшенными свойствами, чем исходный металл. Цветные металлы классифицируют последующим категориям.
Сплавы цветных металлов, в их различных и определенных пропорциях, помогают добиться тех или иных свойств, благодаря которым становится возможным их применение в массовом производстве изделий. Механические, физические и химические свойства сплавов можно менять не только при помощи изменений пропорций исходных металлов, но и путем дополнительного механического или химического воздействия на них, например, термообработкой, применения технологий старения и т.д. К механической обработке цветных металлов относится штамповка, ковка, прессование, прокатка, пайка, сварка и резка.
Тяжелым цветные металлы : свинец, медь, олово, цинк, никель, ртуть.
Легкие цветные металлы : алюминий, титан, магний, бериллий, стронций, кальций, литий, барий, калий, натрий, цезий и рубидий.
Благородные цветные металлы : платина, золото, серебро, осмий, родий, рутений, палладий.
Тугоплавкие цветные металлы: вольфрам и ванадий, молибден и тантал, хром и ниобий, цирконий и марганец.
Рассеянные цветные металлы: индий, таллий, германий, рений, селен, гафний и теллур.
Радиоактивные цветные металлы: уран, торий, радий, нептуний, актиний, америций, протактиний, плутоний, эйнштейний, калифорний, фермий, нобелий, менделевий и лоуренсий.
Многочисленную группу составляют редкоземельные металлы, такие как: тулий, эрбий, прометий, лютеций, церий, лантан, неодим, празеодим, европий, самарий, тербий, гадолиний, иттербий, гольмий, диспрозий,, иттрий и скандий.
Стоит отметить, что большая часть литых изделий, а также проволока, квадраты, шестиугольники в виде прутков и мотков, ленты и полосы, листы и фольга изготавливаются из цветных металлов. В последнее время в производстве даже начали использоваться порошки из данных металлов.
Внутреннее строение металлов

Поскольку металлы в твердом состоянии имеют кристаллическое внутреннее строение, то образующие их элементарные частицы (атомы) в процессе кристаллизации из расплавленного состояния группируются в строго определенной последовательности. Эта последовательность называется кристаллической решеткой, представляющая собой воображаемый элемент объёма, который образован минимальным количеством атомов, чье многократное повторение позволяет построить весь кристалл.
Всего существует 14 различных типов кристаллических решёток. Металлы преимущественно кристаллизуются в одном из трёх типов структур: объёмноцентрированная кубическая (ОЦК), гранецентрированная кубическая (ГЦК) и гексагональная плотноупакованная (ГПУ). Для изображения кристаллической решётки пользуются упрощенными схемами. В объёмно-центрированной кубической решётке содержится девять атомов: восемь расположены в вершинах куба и один – в центре объёма. Такую решётку имеют молибден, вольфрам, ванадий и другие металлы.

Физико-механические свойства металлов и сплавов
Определение и классификация железа
Железо — это название химического элемента, который условно называют низкоуглеродистой сталью или чистое железо. Под чистым железом понимается тяжелый металл серебристо-белого цвета, который содержит не более 0,6% примесей, в том числе углерода ≤0,04% от общего объёма. Эталонное железо, которое может быть получено на сегодняшний день, содержит 99,999% молекул чистого железа, то есть химического элемента Fe . Техническое железо содержит 0,1…0,2% примесей. Следует также отметить, что технически чистое железо имеет невысокие физико-механические характеристики, например твёрдость. Чистого железа в природе практически не встречается, за исключением метеоритов. Это объясняется способностью железа свободно соединяться с другими элементами, особенно с кислородом.

В природе железо чаще всего встречается в составе железных руд в виде оксидов (Fe3O4; Fe2О3; 2Fe2O3*3H2O) и других соединений. После извлечения железа из руд оно содержит в своем составе определенное количество углерода и небольшое количество примесей. Соединение железа с углеродом называется – железоуглеродистый сплав. Сплавы, которые содержат углерод в количестве 0…0,02%, называются техническим железом, 0,02…2,14% – сталями, 2,14…6,67% – чугунами. Свойства железоуглеродистых сплавов, их назначение и способы обработки определяются количеством углерода. Углерод придает сплавам железа прочность и твердость, однако при этом снижает пластичность и вязкость.
Чугун
Чугун является прочным металлическим материалом, который получил свое широкое распространение практически в любой области. Прежде всего, следует рассмотреть производство чугуна. Получение чугуна заключается в восстановлении железа из оксидов железной руды. Производство чугуна ведется преимущественно в доменных печах. Чугун является первичным продуктом переработки железных руд.
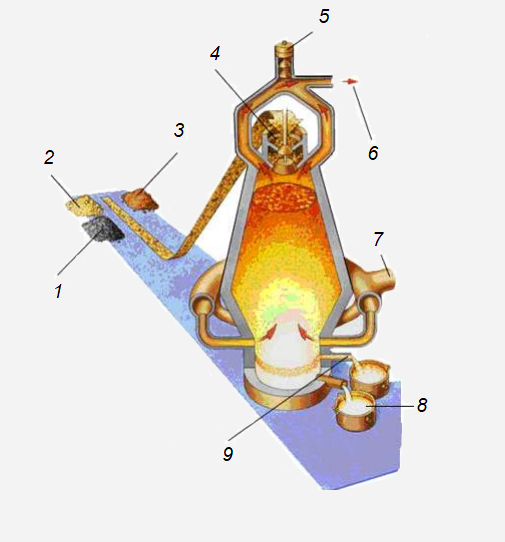
Схема работы доменной печи:
1 – кокс;
2 – известняк;
3 – железная руда;
4 – поступление сырья;
5 – предохранительный клапан;
6 – выход отходящих газов;
7 – поддув горячего воздуха;
8 – чугун;
9 – шлак.
Для производства обычного доменного чугуна используют шихту, которая состоит из железной руды, флюса, окатышей и топлива. В состав железной руды входят железосодержащие минералы и пустая порода. Пригодность железной руды для доменной плавки определяется содержанием железа, составом пустой породы и концентрацией вредных примесей. В зависимости от концентрации железосодержащих минералов железные руды бывают богатыми, которые непосредственно используют, и бедными, которые подвергают обогащению.
Для доменного чугуна в качестве железных руд используются магнитные железняки (магнетит), красные железняки (гематит), бурые железняки (гетит) и шпатовые железняки (сидерит), содержащие около 30…70% железа в виде оксидов Fe2O3 или Fe3O4. В состав пустой породы входят оксиды кремния SiO2 (кремнезём), алюминия Аl2O3 (глинозём), кальция СаО, магния МgO и другие составляющие.
Флюсы предназначены для понижения температуры плавления, обеспечения плавки руды и связывания пустой породы, неизбежно остающейся в руде после процесса рудоподготовки. По химическому составу различают основные флюсы, кислые и нейтральные. К Основным флюсам относится известняк и доломит, к кислым – кремнезём, к нейтральным – глинозём. Они сплавляются с пустой породой и золой топлива, которые вместе образуют легкоплавкий сплав, не смешивающийся с жидким чугуном.
Основным видом топлива в доменном процессе служит кокс и природный газ или пылевидный каменный уголь. Топливо при выплавке чугуна является не только источником тепла, но и принимает участие в окислительно-восстановительных реакциях, протекающих в процессе плавки. Оно является также и основным источником углерода.

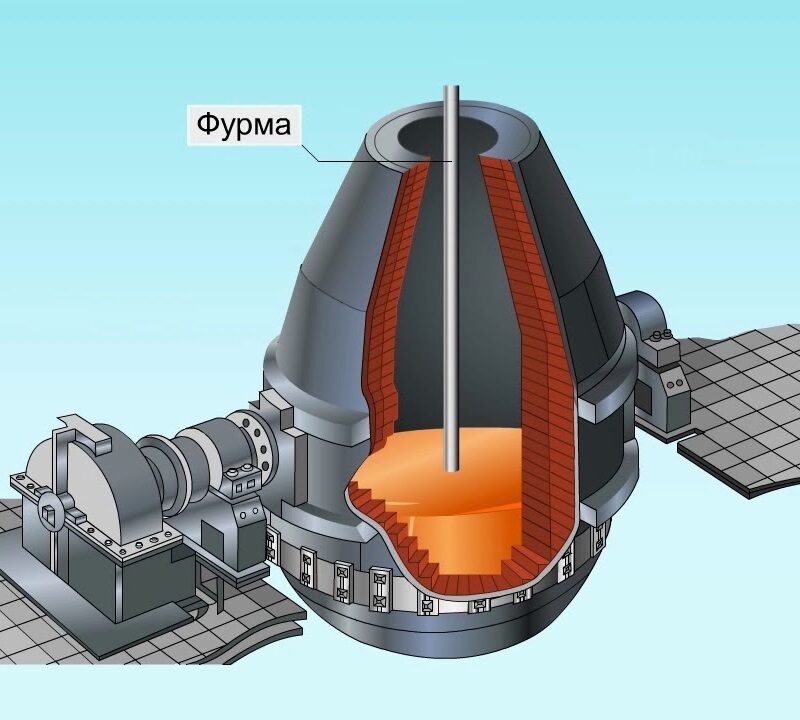
Доменная печь, или как ее еще называют – домна, относится к разряду шахтных и работает по принципу противотока. Внутри печь выложена огнеупорным материалом (чаще всего используют для этого шамотный кирпич), сверху покрыта стальным кожухом. Современные доменные печи имеют общую высоту до 80 метров и объём рабочего пространства до 5600 м 3 , что соответствует 12000 т готового чугуна в сутки.
На сегодняшний день технологический процесс производства чугуна полностью автоматизирован. Шихта непрерывно подается через загрузочные конвейеры в верхнюю часть печи, а снизу через фурмы вдувается горячий воздух. В условиях доменной печи при температуре 1900°С происходит интенсивное насыщение железа углеродом, поэтому доменный чугун обычно содержит от 2,14 до 4,6% углерода, около 93% железа и небольшое содержание примесей кремния (0,5…4%), марганца (1…3%), фосфора (0,02…2,5%), серы (0,005…0,08%) и др., перешедших в чугун из пустой породы. Углерод в чугуне содержится в виде цементита или графита.
Флюсы взаимодействуют с компонентами руды, образуя при этом шлак, который состоит из вредных примесей (сера, фосфор), пустой породы, излишек марганца и некоторых цветных металлов. Доменные газы выпускаются через верхнюю часть печи. Расплавленный чугун стекает вниз, а расплавленный шлак, как более легкая смесь, находится сверху чугуна, предохраняя его от окисления. Жидкий чугун выпускается через нижнюю летку, шлаки – через верхнюю.
В доменных печах получают жидкий передельный и литейный чугуны, доменные ферросплавы, шлак и доменные газы. Чугун является основным и главным продуктом доменного производства, а шлак и доменные газы – побочными. По форме включения графита в сплаве различают:
· серый чугун с пластинчатым графитом (СЧ);
· чугун с вермикулярным (червеобразным) графитом (ЧВГ);
· высокопрочный чугун с шаровидным графитом (ВЧ);
· ковкий чугун с хлопьевидным графитом (КЧ).
В зависимости от химического состава выпускаются нелегированные и легированные чугуны. Легированные чугуны это сплавы для специального назначения, который используется приблизительно тот же комплекс легирующих элементов, что и в сталях: хром, никель, алюминий, молибден и ванадий.
Разновидности чугуна
В зависимости от химического состава и микроструктуры выпускают передельный, литейный, белый, серый, модифицированный, высокопрочный и ковкий чугуны. Разберем по отдельности каждый вид чугуна и выявим их уникальные особенности.
Передельный чугун . Данный вид чугуна содержит 4…4,5% углерода, 0,6…0,8% кремния, 0,25…1,0% марганца, до 0,07% серы и до 0,3% фосфора. В его структуре преобладает цементит, который является твердым и в то же время хрупким соединением. Передельный чугун выпускается трех типов:
· для сталеплавильного (марки П1 и П2) и литейного (ПЛ1 и ПЛ2) производства;
· фосфористый (ПФ1, ПФ2 и ПФ3);
· высококачественный (ПВК1, ПВК2 и ПВК3). На долю передельного чугуна приходится до 90% всей продукции доменных печей.
Нормативы передельного чугуна регламентируются межгосударственным стандартом ГОСТ 805-95.

Литейный чугун . Литейный чугун отличается от передельного повышенным содержанием кремния (до 3,6%) и в некоторых марках фосфора (до 1,2%). В зависимости от массовой доли кремния и назначения чугуна, изготовляют различные марки от Л1 до Л6. Также возможно изготовление чугуна с применением литейного рафинированного магния марок, благодаря чему получаются марки от ЛР1 до ЛР7. Предназначается литейный чугун для дальнейшей переплавки в чугунолитейных цехах при производстве чугунных отливок. Нормативы литейного чугуна регламентируются межгосударственным стандартом ГОСТ 4832-95.
Белый чугун. По сути белый чугун по структуре схож с серым за разницей лишь того, что для каждого вид существуют различные условия охлаждения. Белый чугун получают при быстром охлаждении расплава. По сути это передельные чугуны, в которых весь углерод находится в связанном состоянии в виде цементита. В поперечном сечении они имеют матово-белый цвет и характерный металлический блеск. Из-за большого содержания цементита белые чугуны обладают высокой твёрдостью (450…550 НВ), износостойкостью, хрупкостью, но плохо обрабатывается. Поэтому для изготовления изделий они не используется. Применяются как передельный чугун для производства стали или для отливки деталей с последующим отжигом на ковкий чугун.
Серый чугун. Так называются литейные чугуны с пластинчатой формой графита, в изломе имеющие серый цвет. Содержание углерода в связанном состоянии составляет не более 0,5%. Его получают при медленном охлаждении жидкого чугуна. Механические свойства серого чугуна определяются в основном количеством, формой и размерами графитных структур. По сравнению с металлической основой они имеет более низкую прочность, так как графитные соединения нарушают сплошною структуру материала, что ослабевает металлическую основу. Чем меньше графитовых включений и выше их дисперсность, тем больше прочность чугуна. В случае предварительного подогрева может хорошо свариваться, обладает хорошими литейными свойствами. Выпускается марок СЧ-10…СЧ-35.
В основу стандартизации серого чугуна положен принцип регламентирования минимально допустимого значения временного сопротивления разрыву при растяжении. Например, марка СЧ-15 указывает, что минимальное временное сопротивление при растяжении серого чугуна составляет не менее 150 МПа. В строительстве серый чугун применяют главным образом для изготовления изделий, работающих при сжатии (башмаки, тюбинги, колонны в санитарно-технических системах) и в архитектурно-художественном оформлении.
Высокопрочный чугун. Данный тип чугуна является разновидностью серого, но из-за повышенных механических свойств они состоят в особой группе. Получают при модифицировании жидкого серого чугуна магнием или церием (0,03…0,07% от массы отливки). В результате модифицирования частицы графита находятся в чугуне в виде маленьких сфер, которые исключают образование и распространение трещин. Помимо высокой прочности чугун обладает также высокой пластичностью, что делает его уникальным.
Условное обозначение марки высокопрочного чугуна включает буквы ВЧ – высокопрочный чугун и цифровое обозначение величин предела прочности при растяжении (МПа) и в ряде случаев относительного удлинения (%). Выпускается марок ВЧ-35…ВЧ-100. Например, марка ВЧ 100-2 указывает, что предел прочности при растяжении высокопрочного чугуна составляет 1000 МПа при относительном удлинении 2%.
Высокопрочные чугуны используются в различных отраслях техники, эффективно заменяя при этом сталь во многих изделиях и конструкциях. Из них изготовляют разнообразные профильные трубы, оборудования прокатных станов, кузнечно-прессовые оборудования, корпуса паровых турбин, коленчатые валы и другие детали, работающие при циклических нагрузках и в условиях сильного износа. Нормативы высокопрочного чугуна регламентируются межгосударственным стандартом ГОСТ 7293, EN 1563.
Общие сведения о сталях
Сталь — это деформируемый сплав железа с добавлением углерода и другими обязательными примесями, такие как кремний, сера, фосфор. Сталь занимает левую часть диаграммы состояния железоуглеродистых сплавов (см. изображение выше).
Доля железа ( Fe ) в сплаве составляет около 90…98,5%, а доля углерода не превышает 2,14%. Также в состав стали входят и другие химические элементы, вводимые специально для улучшения показателей свойств или легирования. В этот состав входят такие компоненты как кремний, марганец, фосфор, сера, никель, ванадий, хром и молибден. По сравнению с чугуном сталь имеет лучшие механические свойства, что обусловлено, прежде всего, меньшей концентрацией углерода.
Производство стали и изготовление из нее изделий представляет собой сложный процесс, сочетающий химические и технологические процессы, целый перечень специализированных операций, которые используются для получения качественного металла и различных изделий из него. Исходным сырьем для производства стали являются ферросплавы, металлодобавки, флюсы, окислители, металлошихта, среди которых может быть передельный чугун или стальной лом. Чугун переделывается в сталь в мартеновых или дуговых электросталеплавильных печах.
Если сравнить содержание основных примесей в стали и чугуне, то в стали их на порядок меньше. Следовательно, целью любого металлургического передела чугуна в сталь является снижение содержания углерода и примесей путем их выгорания и перевода в шлак и газы в процессе плавки с последующим раскислением. В результате получается сталь заданного химического состава.
Конвертерный способ производства стали, включающий несколько разновидностей, заключается в том, что залитый в плавильный агрегат жидкий чугун, нагретый до температуры 1250…1400℃, вместе с другими компонентами, включающие в себя металлоломом и шлакообразующие вещества, продувают кислородом через водоохлаждаемую фурму. Кислород воздуха окисляет примеси чугуна, в результате чего происходит повышение температуры до 1600℃ и чугун превращается в сталь. При этом образуется химически активный шлак с необходимым содержанием оксида кальция для удаления примесей. Следовательно, источником теплоты при конвертерном способе являются химические реакции окисления элементов, входящих в состав чугуна. Последними операциями плавки являются слив металла, а затем шлака.
Мартеновский процесс перевлапвки чугуна в сталь осуществляется в плазменной отражательной печи, оснащенной системой регенерации, которая направлена на использование теплоты отходящих при горении газов для подогрева воздуха и газообразного топлива. Металлическая часть шихты для ведения плавки состоит из чугуна и стального лома, доля каждого из которых, может изменяться в процентном соотношении от 0 до 100%. Сталь получается в результате окислительной плавки загруженных в печь железосодержащих материалов и сложных процессов взаимодействия между металлом, шлаком и газовой средой.
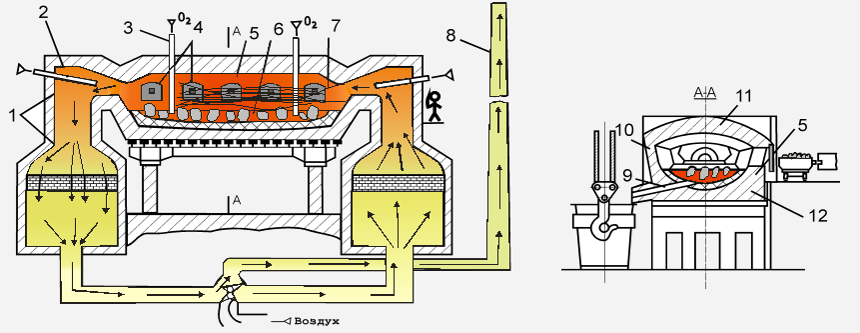
Схема получения стали из мартеновской печи:
1 — регенератор; 2 — головка печи (служит для смешивания топлива с воздухом); 3 — трубка с кислородом
4 — загрузочное окно; 5 — передняя стенка; 6 — шихта; 7 — факел; 8 — дымовая труба; 9 — желоб для выпуска
стали; 10 — задняя стенка; 11 — свод печи; 12 — подина
Выплавка стали в электропечах основана на использовании электроэнергии для нагрева металла. Электрические печи для плавки металла подразделяются на дуговые, индукционные и печи сопротивления. Источником тепла в дуговой печи является электрическая дуга, которая возникают между электродами и жидким металлом или шихтой при приложении к электродам электрического тока необходимой силы. Дуга представляет собой поток электронов, ионизированных газов и паров металла и шлака с температурой, превышающей 3000℃. В индукционных печах для выплавки стали используется тепло, выделяющееся за счет влияния электрического тока переменным магнитным полем. Проводящая электрический ток шихта подвергается воздействию переменного магнитного поля и нагревается вследствие теплового воздействия вихревых токов. Индукционные печи применяют для выплавки высоколегированных сталей и сплавов с низким содержанием углерода, а также для производства тонкостенного фасонного литья.

Выплавка стали в электропечах
Полученную в сталеплавильных агрегатах сталь выпускают в разливочный ковш, а затем либо разливают в металлические формы, либо направляют к машинам непрерывного литья стали. Незначительная часть стали идет на фасонное литье. В результате затвердевания металла получаются стальные слитки или заготовки, которые в дальнейшем подвергают обработке с помощью давления. Технология и организация разливки является весьма ответственным этапом в общем производстве стали и в значительной мере определяет её качество и количество отходов при последующем переделе стальных слитков.
Разновидности сталей
Металлургической промышленностью разных стран вырабатывается более 2 тысяч различных марок сталей и сплавов на основе железа. На долю углеродистых сталей приходится около 80% от общего объёма выплавки.

Углеродистая сталь. Эта сталь представляет собой сплав железа с углеродом, содержащим до 2% углерода и постоянных примесей: кремния – до 0,5%, марганца – до 2%, серы и фосфора – до 0,05%. По содержанию углерода различают низкоуглеродистые (с содержанием углерода до 0,25%), среднеуглеродистые (0,25…0,6%) и высокоуглеродистые (более 0,6%). Содержание углерода и примесей определяют дальнейшую структуру и свойства стали.
С ростом содержания углерода в структуре стали увеличивается количество цементита, при одновременном снижении доли феррита. Данное изменение приводит к повышению прочности и уменьшению пластичности. Однако прочность стали повышается до содержания углерода 0,8…1,0%, а затем с повышением содержания углерода уменьшается не только прочность, но и пластичность, так как образуется грубая сетка вторичного цементита. Увеличение содержания углерода повышает также порог хладноломкости и снижает ударную вязкость, ухудшаются литейные свойства, обрабатываемость давлением и резанием, свариваемость. Однако стали с низким содержанием углерода тоже плохо обрабатываются резанием.
В сталях всегда присутствуют примеси, подразделяющиеся на постоянные или обычные (например, кремний, марганец, сера и фосфор), скрытые (газы в виде кислорода, азота и водорода), специальные (легирующие) и случайные. Наличие примесей в стали объясняется технологической особенностью её производства и невозможностью от их полного полного удаления. Они тоже оказывают существенное влияние на качество стали.
Углеродистые конструкционные стали могут быть обыкновенного качества (по ГОСТ 380-2005) и качественными (по ГОСТ 1050-2015). Для строительных металлических конструкций применяют в основном низкоуглеродистые стали обыкновенного качества, а для важных и ответственных строительных объектов– качественные. В углеродистых сталях обыкновенного качества допускается повышенное содержание примесей, а также газонасыщенность и загрязненность неметаллическими включениями.
В зависимости от содержания углерода, марганца и кремния углеродистая сталь обыкновенного качества подразделяется на марки от Ст0 до Ст6. Буквы «Ст» обозначают «сталь», цифры – условный номер марки в зависимости от химического состава. При этом с увеличением номера содержание углерода в стали возрастает, но прямого количественного соответствия номера и содержания углерода нет. Буквы, которые стоят после номера стали, указывают: «Г» – на содержание марганца при его массовой доле в стали 0,8% и более и «кп», «пс» и «сп» – степень раскисления стали. Чем выше марка стали, тем больше в ней содержание углерода, выше прочность и, соответственно, ниже пластичность.
Качественные углеродистые стали маркируют двузначными цифрами, показывающими среднее содержание углерода в сотых долях процента (05; 08; 10; 25; 40 и др.) и буквами, указывающими на степень раскисления стали. Углеродистая сталь обыкновенного качества используется для изготовления горячекатаного проката: сортового, фасонного, толстолистового и тонколистового проката, широкополосного и холоднокатанного проката, а также слитков, блюмов, слябов, сутунки, труб, лент, проволоки, метизов и других изделий.

Легированная сталь . Легированными называют стали, в которые для получения требуемых свойств вводят специальные добавки других элементов, с соблюдением массовой доли. Чаще всего легирующими добавками являются – никель, хром, молибден, вольфрам, медь и др. Добавки оказывают различное влияние, как на кристаллическое строение, так и на физико-механические характеристики стали. Легированные стали обладают также более высоким уровнем механических и технологических свойств и прежде всего прочности. С помощью легирования можно придать стали различные специальные свойства такие как — антикоррозионную, износостойкость, жаростойкость и тд. По степени легирования (суммарное содержание легирующих элементов) различают низколегированные (менее 2%), среднелегированные (от 2 до 10%) и высоколегированные (более 10%) стали.
Низколегированные конструкционные стали являются переходными между углеродистыми и легированными. Они имеют, по сравнению с углеродистой сталью, повышенную прочность, пониженную склонность к старению, хорошую свариваемость, повышенную износостойкость и коррозионную стойкость в различных средах. В зависимости от количества легирующих элементов стали могут быть трёхкомпонентные (железо + углерод + легирующий элемент), четырёхкомпонентные (железо + углерод + 2 легирующих элемента) и т. д. По наличию основных легирующих элементов сталь подразделяется на группы: хромистая, марганцевая, хромоникелевая, хромокремнистая и др.
По назначению легированные стали подразделяются на конструкционные, инструментальные и с особыми свойствами. Легированная конструкционная сталь (ГОСТ 4543-2016) в зависимости от химического состава и свойств делятся на качественные, высококачественные (А) и особовысококачественные (Ш). По видам обработки при поставке сталь разделяют на горячекатаную, кованую, калиброванную, серебрянку.
В обозначении марок конструкционной легированной стали первые две цифры обозначают содержание углерода в сотых долях процента, а буквы обозначают легирующий элемент. Цифры после букв указывают на среднее содержание данного элемента в целых единицах. Отсутствие цифры означает, что содержание данного легирующего элемента менее 1,5%.

Строительная сталь . Стали, которые используются для изготовления металлических конструкций в сооружениях промышленного и гражданского строительства, пролётных строений мостов, магистральных нефте-газопроводов, армирования бетона называют строительными. Основные требования, предъявляемые к таким сталям – это высокие прочностные параметры (куда включен предел текучести и временное сопротивление разрыву при растяжении), хорошая свариваемость, значительная пластичность, надежность и долговечность. Нормируется также химический состав с указанием предельного содержания углерода, азота, алюминия, кальция, фосфора, серы и других элементов.
В основном для строительных целей применяют низколегированные и углеродистые стали обыкновенного качества. Низколегированные стали содержат до 0,2% углерода, 2…3% легирующих элементов и микродобавки. С увеличением содержания углерода повышается твердость, прочность, улучшается обработка резанием, но снижается пластичность и ухудшается свариваемость. Строительные стали повышенной прочности дополнительно содержат небольшое количество ванадия или ниобия, а также медь в количестве 0,15…0,3%. Благодаря меди повышается стойкость к атмосферной коррозии. Низколегированные строительные стали обладают высокой пластичностью и ударной вязкостью, имеют улучшенные механические свойства и пониженную температуру перехода в хрупкое состояние (от – 40℃ до – 60℃). Поставка строительных сталей с разделением по механическим свойствам в виде листов разной толщины и сортового проката.
Цветные металлы и сплавы

Общие сведения. Доля цветных (не железных) металлов в общем объёме мирового производства металлов составляет немногим более 5%. Объясняется это их небольшим содержанием в земной коре, малым содержанием в рудах, сложностью производства, а, следовательно, и высокой стоимостью. Однако, несмотря на более высокую стоимость и сложность производства, они находят достаточно широкое применение в изготовлении металлических конструкций, различных декоративных элементов, облицовочных панелей, дверей, оконных рам, кровельных материалов, труб и других изделий. И всё это благодаря их уникальным физико-химическим и механическим свойствам.
Цветные металлы обладают большой пластичностью, малой твёрдостью, имеют широкий диапазон температур плавления. Например, температура плавления алюминия 660℃, а тантала – 3015℃. Условно различают лёгкие цветные металлы (плотность до 5000 кг/м 3 ) и тяжёлые – плотностью более 5000 кг/м 3 . К лёгким металлам относят магний, алюминий, титан, бериллий, к тяжёлым – медь, свинец, олово, никель.
Из группы цветных металлов выделяют также легкоплавкие и тугоплавкие металлы. Четкой границы между тугоплавкими и легкоплавкими металлами нет. Условно считается порог в 500℃. К легкоплавким металлам относят олово, свинец, цинк, кадмий, висмут. Некоторые из них используют для приготовления припоев различных составов и назначения. К тугоплавким металлам относят хром, титан, молибден и др. Их используют главным образом в качестве легирующих добавок.
Применяют цветные металлы, как правило, в виде сплавов, так как в чистом виде они обладают недостаточной прочностью. Наибольшее распространение получили сплавы на основе меди, алюминия, титана, олова, магния и других металлов.

Алюминий . В природе алюминия в самородном виде нет. Встречается только в виде соединений. Основным сырьём для промышленного производства алюминия служат бокситы и нефелины, которые содержат до 60% оксида алюминия (глинозема). Процесс получения алюминия является довольно сложным, энергоёмким и включает: получение из бокситов вначале глинозёма, а затем восстановление из раствора глинозёма электролизом в расплавленном криолите металлического алюминия. Образующийся в результате электролиза жидкий алюминий собирается на дне ванны под слоем электролита. Его называют алюминием-сырцом. Он содержит в своём составе металлические и неметаллические примеси, а также газы. Поэтому алюминийсырец рафинируют. После рафинирования образуется технически чистый алюминий, называемый первичным. Расплавленный металл разливается в определенные формы и отправляется в прокатное производство. Выпускается в виде заготовок, отливок, чушек, слитков, катанки, ленты и других изделий.
В зависимости от химического состава и содержания примесей алюминий подразделяется на марки: алюминий особой чистоты А999 (99,999% Аl), высокой чистоты марок: А995 (99,995% Аl), А99 (99,99% Аl), А98 (99,98% Аl), А97 (99,97% Аl), А95 (99,95% Аl) и технической чистоты, допускающих содержание примесей 0,15…1,0% (А85, А8, А7, А6, А5, А35 и А0). Массовую долю алюминия в металле определяют по разности 100,00% и суммы массовых долей определяемых примесей, массовая доля каждой из которых равна или более: для алюминия высокой чистоты – 0,001%, технической чистоты – 0,01%. Например, марка А85 обозначает, что в металле содержится 99,85% алюминия, а в марке А0 – 99% алюминия. В качестве примесей в алюминии могут присутствовать Fe, Si, Cu, Mn, Zn и др. Примеси оказывают существенное влияние на электрические и технологические свойства алюминия, его коррозионную стойкость.
Алюминий представляет собой серебристо-белый лёгкий металл с высокой тепло- и электропроводностью, хорошей коррозионной стойкостью в атмосфере и во многих агрессивных средах. По электропроводности он занимает третье место после серебра и меди. Чем чище алюминий, тем выше его электропроводность и коррозионная стойкость.
На воздухе алюминий покрывается тонкой прочной беспористой плёнкой оксида алюминия (Аl2O3) толщиной примерно 10 нм, защищающей металл от дальнейшего 32 окисления и обусловливающей его высокую коррозионную стойкость. Однако в щелочных средах и некоторых неорганических кислотах алюминий быстро разрушается.
Алюминий обладает высокой технологической пластичностью, сваривается, полируется, но относительно плохо обрабатывается резанием из-за высокой вязкости и налипания металла на инструмент. Вместе с тем он хорошо обрабатывается давлением, поэтому применяется для изготовления тонких листов, проката, в том числе и фольги различного назначения. При холодной пластической деформации (прокатка, волочение) в результате наклёпа получают твёрдый алюминий (АТ), который имеет повышенные механические характеристики (прочность, твёрдость), но при этом снижается относительное удлинение.
В чистом виде алюминий применяют для изготовления фольги, порошка, проволоки. Алюминиевую фольгу (альфоль) в строительстве применяют в качестве эффективного утеплителя (для отражения тепловых лучей) или декоративного материала, порошок – в качестве наполнителя (пигмента) в лакокрасочных составах или газообразователя при изготовлении ячеистых бетонов, проволоку – для сварки конструкций и т. д.
Общая характеристика алюминиевых сплавов

Как железо, так и алюминий в строительстве редко используются в чистом виде. Наибольшее применение находят алюминиевые сплавы. Сырьем для их получения служат как технически чистый алюминий, так и двойные сплавы алюминия с кремнием, которые содержат 10…13% Si и немного отличаются друг от друга количеством примесей железа, кальция, титана и марганца. Общее содержание примесей в них составляет 0,5…1,7% и называют их, как правило, силуминами. Основными легирующими компонентами алюминиевых сплавов являются Cu, Mg, Zn, Mn, Zr и реже – Cr, Li, Ni, Ti, Sc, V, Be и некоторые редкоземельные элементы.
Алюминиевые сплавы сочетают в себе, как правило, лучшие свойства чистого алюминия и повышенные прочностные и эксплуатационно-технологические характеристики легирующих добавок. Например, сплавы с магнием или цинком после термической обработки приобретают прочность, сравнимую с прочностью конструкционной стали с низким содержанием углерода. При этом такой сплав в 2,9 раза легче стали. Прочность на растяжение алюминиевых сплавов составляет 100…700 МПа, относительное удлинение – 6…22%, модуль упругости – 65500…72400 МПа. По прочности их подразделяют на малопрочные (до 300 МПа), среднепрочные (300…480 МПа) и сверхпрочные (более 480 МПа).
Недостатком алюминиевых сплавов являются сравнительно низкий модуль упругости (почти в три раза меньше, чем модуль упругости стали), высокий коэффициент линейного расширения и относительная сложность соединения элементов конструкций.
Алюминиевые сплавы классифицируют по составу, технологии получения заготовок, способности к термической обработке и основным потребительским свойствам. В зависимости от состава различают силумины (Al – Si), магналии (Al – Mg), дюралюмины (Al – Cu – Mg), авиали (Al – Mg – Si) и более сложные (многокомпонентные) с улучшенными свойствами – высокопрочные, жаропрочные, коррозионностойкие и др.
По технологическому признаку (способу изготовления) все алюминиевые сплавы делят на деформируемые (имеющие высокую пластичность в нагретом состоянии) и обрабатываемые давлением – методом горячей или холодной деформации (дюралюмины) и литейные (имеющие хорошую жидкотекучесть), применяемые для отливки изделий (силумины).

Для получения деформируемых сплавов в алюминий вводят в основном растворимые в нем легирующие элементы в количестве, не превышающем предел их растворимости при высокой температуре. Такими легирующими элементами в различных деформируемых сплавах являются медь, магний, марганец и цинк. Кроме того, в сравнительно небольших количествах вводят кремний, железо, никель и др. Наиболее распространенными литейными сплавами являются составы с кремнием или магнием (силумины или магналии).
Как деформируемые, так и литейные алюминиевые сплавы (ГОСТ 4784) подразделяют на термически не упрочняемые и термически и механически упрочняемые. Механическое упрочнение (нагартовка, наклеп) производится обжатием сплава в холодном состоянии. Термическая обработка состоит в закалке сплава нагреванием до температуры 440…510℃ и быстром охлаждении с последующим естественным (при обычных температурах) или искусственным (при t=150℃) старением.
В зависимости от назначения и требований в отношении физико-механических, технологических и других свойств их разделяют на сплавы высокой, средней и малой прочности, свариваемые, заклепочные, декоративные и другие. Они подразделяются также по системам, в которых основные легирующие элементы будут определять типичные для данной системы физические и химические свойства.
В строительстве применяются деформируемые термически упрочняемые и неупрочняемые и литейные, как термически упрочняемые, так и термически не упрочняемые алюминиевые сплавы (ТКП EN 1999-1 Еврокод 9). Однако в строительных конструкциях применяют в основном деформируемые сплавы системы алюминий-магнийкремний и другие. Деформируемые сплавы системы алюминий-магний-кремний наряду с хорошей пластичностью обладают такими свойствами, как высокая коррозионная стойкость, технологичность, способность подвергаться цветному анодированию и эмалированию и др.
Дюралюмины . Это класс сплавов системы «алюминий – медь – магний». Содержание меди составляет 2,2…4%, магния – 0,5…2,4% и в небольших количествах содержатся марганец (0,3…0,9%), кремний и железо. Однако метод изготовления дюраля заключается не только в специфическом подборе компонентов, но и в технологии его изготовления – механизме искусственного или естественного старения с помощью закалки. В результате сплав приобретает высокий уровень свойств при небольшой плотности.

Дюралюмины характеризуются сочетанием высокой прочности и пластичности, хорошо деформируются в горячем и холодном состояниях. Твёрдость и прочность их примерно такая же, как и у сталей обыкновенного качества. Однако при близких значениях прочности коэффициент конструктивного качества у дюралюминов значительно выше. При этом наибольшей прочности дюралюмины достигают при содержании в составе 4% меди и 1% магния. Такие сплавы называются супердюралюмины.
Дюралюмины удовлетворительно обрабатываются резанием в закалённом и состаренном состояниях и плохо в отожжённом, хорошо свариваются точечной сваркой и не свариваются сваркой плавлением из-за образования трещин. Наиболее известны сплавы Д1, Д16, Д18, Д19 и др. Например, сплав Д16 используется в строительных конструкциях средней и повышенной прочности.
Недостатком дюралюминов является их пониженная коррозионная стойкость. Для защиты от коррозии дюралюмины плакируют чистым алюминием, подвергают электрохимическому оксидированию либо естественному старению.
Силумины . Это группа литейных сплавов алюминия с кремнием (4…22%) и незначительным количеством примесей – железа, меди, магния, титана, цинка и других элементов (ГОСТ 1583). Название произошло от наличия в составе химического элемента Si. Силумины дополнительно могут быть легированы магнием, медью, никелем, титаном, что позволяет упрочнять такие сплавы термической обработкой. По сравнению с чистым алюминием обладают большей прочностью и износостойкостью, но уступают по этим показателям дюралюмину. Для силуминов характерна низкая литейная усадка, стойкость к коррозии и высокая твердость. Применяют при изготовлении строительных конструкций.
Магналии. Магналии – сплавы алюминия с магнием Mg до 10% и другими элементами (кремний, железо, медь). В зависимости от содержания магния различают деформируемые (до 7% Mg) и литейные (5…10% Mg) сплавы. Магний уменьшает плотность алюминиевого сплава, повышает прочность и коррозионную стойкость без снижения пластичности. Поэтому основным преимуществом таких сплавов является сочетание сравнительно высокой прочности, пластичности и коррозионной стойкости с хорошей свариваемостью. Магналии легко поддаются механической обработке и хорошо полируются. Применяются в качестве конструкционного и декоративного материала. Авиаль (сокращенное от «авиационный алюминий») – группа сплавов системы алюминий – магний (0,45…0,9%) – кремний (0,5…1,2%) с небольшим содержанием других элементов марганца или хрома (0.15…0,35%), меди (0,2…0,6%) и железа – не более 0,5%.
Авиали. Авиали относятся к числу сплавов со средней прочностью, но высокой технологичностью и стойкостью против атмосферной коррозии. Отличаются высокой пластичностью и свариваемостью, хорошо полируются. Для упрочнения подвергают закалке и искусственному старению. В строительстве применяются в виде профилей, труб, обшивки строительных конструкций и других изделий.
Маркировка алюминиевых сплавов

Единой системы маркировки черных и цветных металлов, в т. ч. алюминиевых сплавов в мировом сообществе не разработано. Маркировку алюминиевых сплавов в РБ и в странах СНГ определяют в основном стандарты: ГОСТы 1583 и 4784, ГОСТ Р 55375 и EN 573-1. Отличия в системах маркировки алюминиевых сплавов вызваны различием в технологиях производства, требованиях к свойствам, области применения и другим параметрам. В настоящее время осуществляется замена различных систем условных обозначений на единую систему цифровой маркировки алюминиевых сплавов.
Что касается европейских норм, то они предусматривают раздельные системы маркировки (кодирования) для деформируемых и литейных алюминиевых сплавов, основанные на Международной системе обозначений. Деформируемые алюминиевые сплавы имеют, как правило, буквенно-цифровую систему маркировки. Обозначение последовательно составляется из букв EN, затем следует пробел, букв А (алюминий) и W (деформируемый полуфабрикат), дефис и четырех цифр, представляющих химический состав, и при необходимости за ними буквы, указывающей национальную вариацию. Например, EN AW-5154А.
Литейные сплавы тоже имеют буквенно-цифровое обозначение, которое состоит из тех же букв EN, A и далее букв, указывающих на форму полуфабриката (А, С, М) и пяти цифр, показывающих их пределы содержания элементов химического состава. Например, EN AВ-44000.
Медь . Медь (лат. сuprum – от названия острова Кипр, где в древности добывали медную руду) среди цветных металлов по объёму потребления занимает второе место после алюминия. В чистом виде в природе встречается крайне редко в виде самородков, в которых содержание меди может доходить до 99%. В промышленном масштабе производят в основном из руд, либо из отходов меди и её сплавов. Наиболее востребованными рудами для производства меди являются сульфидные – медный колчедан (CuS·FeS), халькозин (Cu2S), ковеллин (CuS) и др., содержащие до 5% меди. Технологический процесс производства меди является довольно сложным и длительным по времени (несколько суток). Он включает подготовку руды к плавке (обогащение) и получение медного концентрата с содержанием меди до 35%. Затем производят обжиг медного концентрата, плавку и получение так называемого медного штейна. Последующими технологическими операциями являются плавка штейна (сократительная) с целью повышения содержания в нем меди, конвертирование медного штейна – получение сначала белого штейна с содержанием меди до 79%, а затем черновой (сырой) меди, содержащей уже более 99% Сu. При этом примеси переходят в шлак и удаляются, а чистую медь разливают в формы. Заключительным этапом является электролитическое рафинирование отливок и получение меди необходимой чистоты.
Свойства полученной меди (ГОСТ 859) зависят от чистоты, а уровень содержания примесей определяет её марку: М00к – не менее 99,99% Сu, М0к – 99,97% Сu, М1к – 99,95% Сu, М2к – 99,93% Сu и др. В обозначении марок после буквы М (медь) указывается условный номер чистоты, а затем буквой способ и условия получения меди: к – катодная; б – бескислородная; р – раскисленная; ф – раскисленная фосфором. Вредными примесями, снижающими механические и технологические свойства меди и её сплавов, являются свинец, висмут, сера и кислород. Содержание их в меди строго ограничено: висмута – не более 0,005%, свинца – 0,05% и т. д. Все примеси, как правило, снижают и электрическую проводимость меди.
Цвет меди – красноватый (в изломе розовый), в очень тонких слоях на просвет зеленовато-голубой. Эти же цвета характерны и для многих соединений меди. Медь – единственный металл, имеющий красноватый цвет. Это и отличает её от всех других металлов. Чистая медь обладает высокой электро- и теплопроводностью, наивысшей после серебра. Поэтому медь принято считать эталоном электро- и теплопроводности по отношению к другим металлам. Характеристики этих свойств меди и сплавов с её высоким содержанием по международному стандарту на отожжённую медную проволоку (IACS) принимаются за 100%, в то время как у алюминия, магния и железа они составляют соответственно 60, 40 и 17% от свойств меди.



Медь относится к малоактивным металлам. При обычных условиях она не взаимодействует с водой, растворами щелочей, соляной и разбавленной серной кислотой. Однако, в других кислотах (азотной, концентрированной серной) – медь растворяется. При взаимодействии её с уксусной кислотой образуется основной ацетат меди – ядовитая ярь-медянка. Способность меди растворяться в азотной кислоте используется в промышленности для определения её наличия в сплавах. Если кислота при взаимодействии с образцом металла приобретает сине-зелёный цвет, значит в составе металла присутствует медь.
На воздухе и в сухих условиях медь не окисляется. При наличии же углекислого газа и влаги медь окисляется и покрывается тонкой плёнкой карбоната меди под названием «патины» зелёного цвета. В дальнейшем эта плёнка в определённой мере способна защищать медь от коррозии.
Медь в чистом виде обладает высокой пластичностью и отличной обрабатываемостью давлением в холодном и горячем состояниях, хорошими литейными свойствами. Температура её плавления составляет 1083℃. Она хорошо прокатывается в тонкие листы и ленту, из неё получают тонкую проволоку. При этом холодная пластическая деформация (достигающая 90% и более) увеличивает прочность, твёрдость, предел упругости меди, но снижает пластичность и электрическую проводимость. Медь хорошо паяется и сваривается. Обладает хорошим блеском и высокой полируемостью, однако блеск её довольно быстро исчезает. Недостаток меди – сравнительно невысокая прочность, плохая обрабатываемость резанием и низкая жидкотекучесть.
Технически чистую медь поставляют в виде листов или полуфабрикатов – слитков, предназначенных для дальнейшего передела прокаткой. В строительстве медь применяется в основном для изготовления водопроводных труб, кровельной черепицы и других изделий. Более 30% меди используется для производства медных сплавов.
Для легирования медных сплавов используют элементы, растворимые в меди – Zn, Sn, Al, Be, Si, Mn, Ni. В зависимости от легирующего элемента все сплавы меди подразделяются на латуни, бронзы и медноникелевые.

Латунь. Это сплавы меди с цинком и другими элементами, в которых цинк является основным легирующим элементом (ГОСТы 15527 и 17711). На практике применяют латуни двойные и специальные (легированные). Цинк повышает прочность и пластичность сплава, но до определенных пределов. Наибольшей пластичностью обладают латуни, содержащие 30% цинка, а наибольшей прочностью – 45%. Латуни имеют золотисто-жёлтый цвет и по сравнению с медью обладают большими прочностью, твёрдостью, упругостью, коррозионной стойкостью и лучшими технологическими свойствами (жидкотекучестью, обрабатываемостью литьём, давлением, резанием). Электро- и теплопроводность латуней тоже ниже, чем меди.
Бронза. Бронза является одним из древнейших металлических материалов. Она дала название целой эпохе развития человечества – бронзовому веку. В настоящее время бронзой называют медные сплавы, обычно с оловом как основным легирующим компонентом, и другими металлами кроме цинка и никеля. Цинк и никель могут вводиться в бронзы только как дополнительные легирующие элементы. При этом медноникелевые сплавы выделяют в особую группу. Следовательно, по химическому составу бронзы подразделяют на оловянные и безоловянные, а название получают по основному легирующему элементу, образующему сплав (алюминиевые, кремнистые и др.).
В целом же бронзы по сравнению с латунями обладают лучшими механическими, антифрикционными свойствами и антикоррозионной стойкостью. Структура и свойства их изменяются в зависимости от содержания легирующих элементов, скорости охлаждения сплава, разновидности и характера термической и других видов обработки. Отжиг, например, снимает напряжения, устраняет наклёп и позволяет получать сплавы однородной структуры. Закалка при температуре 700…750℃ без отпуска увеличивает пластичность сплава, а с отпуском – повышает прочность и твёрдость.
Сплавы меди, никеля и других элементов, в которых основным легирующим элементом является никель, называют медноникелевыми. Как правило, они имеют серебристо-белый цвет, несмотря на преимущественное содержание меди. Введение никеля существенно упрочняет медь, не меняя практически характеристик пластичности и ударной вязкости. При этом повышается коррозионная стойкость, технологичность, сплав приобретает особые электрические свойства. По назначению медноникелевые сплавы подразделяют на конструкционные и электротехнические. К конструкционным относятся высокопрочные и коррозионностойкие сплавы типа куниаль, нейзильбер и мельхиор, к электротехническим – копель, манганин и константан.
Металлические изделия

Определение и классификация . Металлургическая промышленность выпускает металлические изделия различной номенклатуры. Наиболее массовым видом продукции металлургических предприятий является металлический прокат – изделия, получаемые на прокатных станах путём горячей или холодной прокатки (холодное 39 формование). Выпускаются также гнутые, кованые, калиброванные и со специальной отделкой поверхности металлические изделия (ГОСТ 1435 и 1050)
Материалом для изготовления металлических изделий являются различные виды стали (от углеродистых до высоколегированных) и цветные металлы и сплавы (алюминиевые, медные и др.). По состоянию материала металлопродукцию (состоянию поставки) изготовляют изделия без термической обработки, термически обработанной, нагартованной (для калиброванной и со специальной отделкой поверхности) и подвергнутой противофлокенной обработке (выдержке при определенной температуре и последующему замедленному охлаждению).
Весь перечень металлического проката называется сортаментом и условно подразделяется на сортовой, толстолистовой, широкополосный универсальный, фасонный и гнутые профили (ГОСТ 535 и 19281). К сортовому относят прокат, у которого касательная в любой точке контура поперечного сечения данное сечение не пересекает. Прокат выпускается в листах, прутках, мотках, рулонах (штрипсах), полосовой и различного профиля.
Изделия сортового проката производят:
· круглого сечения диаметром от 5 до 330 мм. Прокат диаметром до 9 мм включительно выпускается в мотках, свыше 9 мм – в прутках длиной от 2 до 13 м (ГОСТ 2590);
· квадратного сечения с размерами сторон от 6 до 200 мм в мотках и прутках длиной от 2 до 13 м (ГОСТ 2590);
· шестигранного сечения диаметром вписанного круга от 8 до 103 мм в мотках и прутках длиной от 2 до 13 м (ГОСТ 2879);
· прямоугольного сечения (полоса) толщиной от 4 до 80 мм, шириной от 10 до 200 мм, длиной от 2 до 13 м и других размеров (ГОСТ 103). Кроме того, выпускают прокат:
· толстолистовой, тонколистовой и широкополосный универсальный, в т. ч. рулонный (штрипс) горячекатаный, холоднокатаный и оцинкованный шириной 500 мм и более, толщиной от 0,35 до 160 мм повышенной и обычной точности (ГОСТ 82, 19903, 19904, 16523, 9045, 14637, 14918 и 1577);
· арматуру (прокат арматурный) – изделия для армирования железобетонных конструкций (СТБ 1704, ГОСТ Р 52544);
· листы горячекатаные – просечно-вытяжной и рифленый с односторонним ромбическим, чечевичным (ГОСТ 8568) и другими видами рифления (в листах и рулонах);
· ленту стальную (холоднокатаную и горячекатаную) шириной от 20 до 220 мм и толщиной от 1,2 до 5 мм и другие изделия.
Основными качественными характеристиками таких изделий являются точность прокатки (повышенная, обычная и др.), отклонения в размерах и форме поперечного сечения и другие на соответствие стандарта.

К фасонному относят прокат, у которых касательная хотя бы в одной точке контура поперечного сечения данное сечение пересекает. Поперечное сечение таких изделий напоминает латинские буквы L (уголок), U (швеллер) и H (двутавр):
· уголки равнополочные размером от 20х20 до 250х250 мм и неравнополочные размером от 30х20 до 200х125 мм (ГОСТ 8509 и 8510);
· швеллеры высотой от 50 до 400 мм и шириной полок от 32 до 115 мм (ГОСТ 8240);
· двутавры с уклоном внутренних граней и полок высотой от 100 до 600 мм и шириной полки от 55 до 190 мм (ГОСТ 8239) и с параллельными гранями полок высотой от 100 до 1000 мм и шириной полок от 55 до 400 мм (ГОСТ 26020);
· профили специального назначения – профилированные листы (профнастил, гофролист) представляют собой стальные холодногнутые листовые профили в форме волны, прямоугольника или трапеции. Изготавливаются в стеновом и кровельном исполнении (ГОСТ 24045).
· кованые прутки квадратные и круглые (ГОСТ 1133), калиброванную холоднотянутую и холоднокатанную сталь круглого сечения (ГОСТ 7417), кованые полосы (ГОСТ 4405);
· профили гнутые различных поперечных сечений, изготовляемые на профилегибочных станах из холоднокатаного или горячекатаного проката, имеющие поперечное сечение одинаковое по всей длине (ГОСТ 14350).
Для стальных строительных конструкций используют листовую и сортовую сталь. Кроме того, применяют вторичные профили: сварные, получаемые сваркой полос или листов, и гнутые, образованные холодной гибкой полос и листов.
Из цветного металлопроката самыми востребованными в строительстве являются изделия на основе алюминия, меди и титана (ГОСТ 1535, 1628, 21488). Например, алюминиевые сплавы широко применяются для производства листов (ГОСТ 21631), плит (ГОСТ 17232), лент (ГОСТ 13726), различных профильных полуфабрикатов (ГОСТ 8617 и 24767), труб (ГОСТ 18475 и 18482), проволоки, для изготовления кровельных настилов, стеновых панелей, оконных и фонарных переплетов и других изделий (ГОСТ 4784 и 22233, ГОСТ Р 57352/EN 1090-3, СТБ EN 485, 573, 755, 12020).
Профильные полуфабрикаты включают прессованные и холодногнутые профили, листы и ленты (в рулонах), профилированные листы (гофрированные), тисненые листы. Профили могут быть сплошного и переменного сечений, пустотелые (полые) и в виде панелей. Применяют их в ограждающих и несущих конструкциях (балки, арки, фермы, рамы), для окон и дверей, солнцезащитных устройств, при ремонте и модернизации зданий. Изделия, которые изготавливает наша производственная из металлического проката компания приведены ниже:
Самый легкий металл из используемых в промышленности – Самые легкие металлы в мире
В сознании многих людей металлы ассоциируются с чем-то тяжелым и твердым. Но в то же время есть металлические элементы, которые легче воды и не тонут в ней, а плавают на поверхности. Это происходит из-за больших размеров атомов и как следствие малой плотности. Так какой же металл самый легкий? Достаточно взглянуть на периодическую систему Менделеева, чтобы понять, что это литий. Он почти вдвое легче воды.

Основные свойства лития
Плотность лития составляет всего 0,543 грамма на сантиметр кубический. Металл входит в щелочную группу, которая характеризуется очень высокой химической активностью. Поэтому в природе литий образует сложные многоэлементные соединения, входящие в состав горных пород. При этом литий является самым неактивным щелочным металлом, так что достаточно устойчиво проявляет себя после выделение в чистом виде. Физические свойства самого легкого металла на Земле выглядят следующим образом: в нормальных условиях серебристо-белый металл, мягкий (можно резать ножом), ковкий и пластичный. Температура плавления — 181 градус по Цельсию. Атомная масса — 6,941 .
Химические свойства характерны для металлов щелочной группы. Но литий, в отличие от остальных щелочных элементов при комнатной температуре медленно реагирует с кислородом и другими веществами. Зато при нагревании вступает в реакцию с газами, кислотами и основаниями. При нагревании до 300 градусов по Цельсию литий самовоспламеняется и горит красно-синим пламенем. В отличие от остальных элементов щелочной группы покрывается устойчивой оксидной пленкой и перестает реагировать с кислородом. 
Литий не хранят в керосине, так как из-за малой плотности он плавает на поверхности. Для его длительного хранения используют петролейный эфир, парафин, газолин или минеральное масло. В качестве емкости применяют жестяные банки с герметично закрывающимися крышками. Литий является токсичным веществом и при попадании на открытые участки кожи вызывает зуд, раздражение и ожоги, поэтому при работе с ним необходимо использовать специальную защитную одежду. Пары лития обжигают верхние дыхательные пути, так что нужно позаботиться и о защите органов дыхания.
Производство самого легкого металла в мире сводится к разложению его природных соединений. Это достаточно трудоемкая процедура ввиду большого количества составных элементов. Содержание лития в добываемом сырье в среднем составляет 21 грамм на одну тонну. В промышленном производстве используют три метода разложения соединений лития: известковый, сульфатный и сернокислотный. Первые два подразумевают спекание руды с оксидом/карбонатом кальция или сульфатом калия. 
Протекает процедура при температуре 250-300 градусов. Затем полученную массу обрабатывают водой, получая карбонат или сульфат лития. После этого проводится процедура хлорирования с целью получения хлорида лития. И, наконец, окончательную процедуру разделения проводят при помощи электролиза расплава в присутствии хлорида калия или бария, которые понижают температуру плавления литиевого хлорида. Чистый металл оседает на катоде, откуда его можно собирать для дальнейшей переработки.
Сернокислотный способ подразумевает растворение руды в серной кислоте с образованием сульфата лития. Дальнейшая процедура протекает по указанной выше схеме. Самый легкий металл применяется для производства эффективных полупроводников в сплавах с другими металлами, из него изготавливают аноды, используемые затем в процедурах электролиза, литий входит в состав ракетного топлива, в металлургии применяется в качестве сильного восстановителя менее активных металлов. В качестве различных соединений литий используется в производстве продукции для многих отраслей промышленности и народного хозяйства.
Запишите уравнения,иллюстрирующие химические свойства лития. Спасибо!
Люди научились использовать полезные свойства самых легких металлов. Некоторые из них применяют в чистом виде, однако сфера применения легких сплавов металлов гораздо более обширна. Где используют самые легкие металлы? Известно, что самый легкий металл – литий. Однако существует металл, который еще легче. Таковым является микролаттис. Он был получен учеными Калифорнийского университета. Этот сверхлегкий твердый металл в сотню раз легче пенополистирола. Литий самый легкий металл из таблицы Менделеева Литий самый легкий металл из таблицы Менделеева Кусочек микролаттиса, положенный на одуванчик, его даже не деформирует. Данный металл способен выдерживать колоссальные нагрузки для своего веса. Благодаря таким свойствам, его применяют во многих сферах жизнедеятельности человека: используют при производстве электродов для батарей, в аэрокосмической промышленности и автопромышленности для звуко- и теплоизоляции. Микролаттис самый легкий металл в мире Микролаттис самый легкий металл в мире Литий широко применим в сплавах. Используют его при изготовлении анодов химических источников тока, оптики, высокоэффективных лазеров. При приготовлении электролита щелочных аккумуляторов в качестве одного из компонентов используют гидроксид лития. Взяв за основу силикат и алюминат лития, создали керамику, которая способна застыть при комнатной температуре, что стало незаменимо в металлургии, военной технике, а в будущем и в термоядерной энергетике. Соли лития успешно применяются в медицине, чаще им лечат психические заболевания. Так, карбонат лития способен стабилизировать настроение людей. В текстильной промышленности с помощью соединений лития происходит процесс отбеливания тканей. Без лития не обходится пищевая промышленность и фармацевтика. Легкий металл алюминий применяется во многих отраслях Легкий металл алюминий применяется во многих отраслях В конструкционных материалах не обходятся без бериллия и магния, а вот кальций и стронций, притом, что они легче алюминия, почти не используются. Бериллий не только очень легкий металл, но и редкий, а следовательно дорогой. Кроме того, он токсичен. Бериллий применяют в тех сферах, где он незаменим, в том числе в космической промышленности. Еще один металл из разряда самых легких – алюминий. Он получил звание металла двадцатого века. Область его применения весьма широка. Из него производят строительные конструкции, алюминиевую фольгу, электропровода, консервные банки, взрывчатые смеси, пиротехнические составы и т.д. Легкие сплавы металлов Не смотря на то, что активно развивается производство полимерных материалов, использование самых легких металлов не стало второстепенным, объем производства только растет. Более всего это касается алюминия и его сплавов. Сплав алюминия и лития нашел широкое применение в авиакосмической промышленности. Этот сплав превосходит многие иные сплавы по ряду параметров, а так же может конкурировать с пластмассами, упроченными волокнами. Для обеспечения вязкости сплава в него вводят легирующие элементы: медь, марганец, цирконий. Алюмо-литиевые сплавы обладают необходимой жесткостью при малой плотности, благодаря чему незаменимы как материалы для легких конструкций. Велосипеды делают из легких алюмо-литиевых сплавов Велосипеды делают из легких алюмо-литиевых сплавов Сплавы магния многочисленны. У них высокая удельная прочность при весьма низкой плотности, что незаменимо для конструкционных материалов в авиакосмической технике. Магний придает сплавам легкость, делая их легче алюминия на треть. Алюминий и алюминиевые сплавы широко применяются во многих сферах, по распространенности они на второй позиции после железа и его сплавов. Однако алюминий не столь применим в чистом виде, сколько именно в сплавах. Они отличаются высокой коррозионной стойкостью, у них малая плотность, а так же очень высокие технологические свойства. Сплавы алюминия нашли применение в архитектуре, быту, судостроении, космической технике. Сплавы из легкого алюминия принимают в авиастроении Сплавы из легкого алюминия принимают в авиастроении Из сплавов алюминия с магнием и медью производят автомобильные детали и делали для авиационного производства. Есть жаропрочные и морозоустойчивые высокопрочные сплавы алюминия, использующиеся как декоративные и разнообразные защитные покрытия. В ядерном ракетостроении применяют циркалой, являющийся сплавом алюминия и циркония. Мощное взрывчатое вещество – алюмотол, одна из его составляющих – порошок алюминия. Легкий сплав циркалой применяют в ядерной промышленности Легкий сплав циркалой применяют в ядерной промышленности Самый легкий металл в мире Среди металлов есть очень легкие, это те, чья плотность не превышает пяти г/см3. Это литий, цезий, натрий, калий, алюминий, магний, кальций и барий. Самым легким из всех является литий 1л, плотность которого 0,534 г/см3. Как известно, этот металл даже не тонет в воде. Литий был открыт химиком Арфведсоном в 1817-ом году. Спустя семь лет литий вывели лабораторным путем. Внешне этот металл напоминает лед, даже имеет тот же серебристый оттенок, однако он пластичный и мягкий. Металл литий настолько легкий, что не тонет в воде Металл литий настолько легкий, что не тонет в воде В чистом виде этот легкий металл не используется, так как активно взаимодействует с окружающей его средой. Обычно литий сплавляют с натрием или другими металлами. Без лития не обходятся при изготовлении пиротехники, в оптике, в термоядерном оружии, в качестве окислителя. Так же без него не обходятся в фармацевтике, пищевой, текстильной и силикатной промышленности. Некоторые сплавы лития оказались полезными в авиа-космической промышленности и электронике. Легкий литий используется в высокотехнологичных отраслях Легкий литий используется в высокотехнологичных отраслях Ну а в список самых твердых металлов литий и натрий не выходят. По данным uznayvse.ru, самый твердый металл это титан.
Люди научились использовать полезные свойства самых легких металлов. Некоторые из них применяют в чистом виде, однако сфера применения легких сплавов металлов гораздо более обширна. Где используют самые легкие металлы? Известно, что самый легкий металл – литий. Однако существует металл, который еще легче. Таковым является микролаттис. Он был получен учеными Калифорнийского университета. Этот сверхлегкий твердый металл в сотню раз легче пенополистирола. Литий самый легкий металл из таблицы Менделеева Литий самый легкий металл из таблицы Менделеева Кусочек микролаттиса, положенный на одуванчик, его даже не деформирует. Данный металл способен выдерживать колоссальные нагрузки для своего веса. Благодаря таким свойствам, его применяют во многих сферах жизнедеятельности человека: используют при производстве электродов для батарей, в аэрокосмической промышленности и автопромышленности для звуко- и теплоизоляции. Микролаттис самый легкий металл в мире Микролаттис самый легкий металл в мире Литий широко применим в сплавах. Используют его при изготовлении анодов химических источников тока, оптики, высокоэффективных лазеров. При приготовлении электролита щелочных аккумуляторов в качестве одного из компонентов используют гидроксид лития. Взяв за основу силикат и алюминат лития, создали керамику, которая способна застыть при комнатной температуре, что стало незаменимо в металлургии, военной технике, а в будущем и в термоядерной энергетике. Соли лития успешно применяются в медицине, чаще им лечат психические заболевания. Так, карбонат лития способен стабилизировать настроение людей. В текстильной промышленности с помощью соединений лития происходит процесс отбеливания тканей. Без лития не обходится пищевая промышленность и фармацевтика. Легкий металл алюминий применяется во многих отраслях Легкий металл алюминий применяется во многих отраслях В конструкционных материалах не обходятся без бериллия и магния, а вот кальций и стронций, притом, что они легче алюминия, почти не используются. Бериллий не только очень легкий металл, но и редкий, а следовательно дорогой. Кроме того, он токсичен. Бериллий применяют в тех сферах, где он незаменим, в том числе в космической промышленности. Еще один металл из разряда самых легких – алюминий. Он получил звание металла двадцатого века. Область его применения весьма широка. Из него производят строительные конструкции, алюминиевую фольгу, электропровода, консервные банки, взрывчатые смеси, пиротехнические составы и т.д. Легкие сплавы металлов Не смотря на то, что активно развивается производство полимерных материалов, использование самых легких металлов не стало второстепенным, объем производства только растет. Более всего это касается алюминия и его сплавов. Сплав алюминия и лития нашел широкое применение в авиакосмической промышленности. Этот сплав превосходит многие иные сплавы по ряду параметров, а так же может конкурировать с пластмассами, упроченными волокнами. Для обеспечения вязкости сплава в него вводят легирующие элементы: медь, марганец, цирконий. Алюмо-литиевые сплавы обладают необходимой жесткостью при малой плотности, благодаря чему незаменимы как материалы для легких конструкций. Велосипеды делают из легких алюмо-литиевых сплавов Велосипеды делают из легких алюмо-литиевых сплавов Сплавы магния многочисленны. У них высокая удельная прочность при весьма низкой плотности, что незаменимо для конструкционных материалов в авиакосмической технике. Магний придает сплавам легкость, делая их легче алюминия на треть. Алюминий и алюминиевые сплавы широко применяются во многих сферах, по распространенности они на второй позиции после железа и его сплавов. Однако алюминий не столь применим в чистом виде, сколько именно в сплавах. Они отличаются высокой коррозионной стойкостью, у них малая плотность, а так же очень высокие технологические свойства. Сплавы алюминия нашли применение в архитектуре, быту, судостроении, космической технике. Сплавы из легкого алюминия принимают в авиастроении Сплавы из легкого алюминия принимают в авиастроении Из сплавов алюминия с магнием и медью производят автомобильные детали и делали для авиационного производства. Есть жаропрочные и морозоустойчивые высокопрочные сплавы алюминия, использующиеся как декоративные и разнообразные защитные покрытия. В ядерном ракетостроении применяют циркалой, являющийся сплавом алюминия и циркония. Мощное взрывчатое вещество – алюмотол, одна из его составляющих – порошок алюминия. Легкий сплав циркалой применяют в ядерной промышленности Легкий сплав циркалой применяют в ядерной промышленности Самый легкий металл в мире Среди металлов есть очень легкие, это те, чья плотность не превышает пяти г/см3. Это литий, цезий, натрий, калий, алюминий, магний, кальций и барий. Самым легким из всех является литий 1л, плотность которого 0,534 г/см3. Как известно, этот металл даже не тонет в воде. Литий был открыт химиком Арфведсоном в 1817-ом году. Спустя семь лет литий вывели лабораторным путем. Внешне этот металл напоминает лед, даже имеет тот же серебристый оттенок, однако он пластичный и мягкий. Металл литий настолько легкий, что не тонет в воде Металл литий настолько легкий, что не тонет в воде В чистом виде этот легкий металл не используется, так как активно взаимодействует с окружающей его средой. Обычно литий сплавляют с натрием или другими металлами. Без лития не обходятся при изготовлении пиротехники, в оптике, в термоядерном оружии, в качестве окислителя. Так же без него не обходятся в фармацевтике, пищевой, текстильной и силикатной промышленности. Некоторые сплавы лития оказались полезными в авиа-космической промышленности и электронике. Легкий литий используется в высокотехнологичных отраслях Легкий литий используется в высокотехнологичных отраслях
Люди научились использовать полезные свойства самых легких металлов. Некоторые из них применяют в чистом виде, однако сфера применения легких сплавов металлов гораздо более обширна. Где используют самые легкие металлы? Известно, что самый легкий металл – литий. Однако существует металл, который еще легче. Таковым является микролаттис. Он был получен учеными Калифорнийского университета. Этот сверхлегкий твердый металл в сотню раз легче пенополистирола. Литий самый легкий металл из таблицы Менделеева Литий самый легкий металл из таблицы Менделеева Кусочек микролаттиса, положенный на одуванчик, его даже не деформирует. Данный металл способен выдерживать колоссальные нагрузки для своего веса. Благодаря таким свойствам, его применяют во многих сферах жизнедеятельности человека: используют при производстве электродов для батарей, в аэрокосмической промышленности и автопромышленности для звуко- и теплоизоляции. Микролаттис самый легкий металл в мире Микролаттис самый легкий металл в мире Литий широко применим в сплавах. Используют его при изготовлении анодов химических источников тока, оптики, высокоэффективных лазеров. При приготовлении электролита щелочных аккумуляторов в качестве одного из компонентов используют гидроксид лития. Взяв за основу силикат и алюминат лития, создали керамику, которая способна застыть при комнатной температуре, что стало незаменимо в металлургии, военной технике, а в будущем и в термоядерной энергетике. Соли лития успешно применяются в медицине, чаще им лечат психические заболевания. Так, карбонат лития способен стабилизировать настроение людей. В текстильной промышленности с помощью соединений лития происходит процесс отбеливания тканей. Без лития не обходится пищевая промышленность и фармацевтика. Легкий металл алюминий применяется во многих отраслях Легкий металл алюминий применяется во многих отраслях В конструкционных материалах не обходятся без бериллия и магния, а вот кальций и стронций, притом, что они легче алюминия, почти не используются. Бериллий не только очень легкий металл, но и редкий, а следовательно дорогой. Кроме того, он токсичен. Бериллий применяют в тех сферах, где он незаменим, в том числе в космической промышленности. Еще один металл из разряда самых легких – алюминий. Он получил звание металла двадцатого века. Область его применения весьма широка. Из него производят строительные конструкции, алюминиевую фольгу, электропровода, консервные банки, взрывчатые смеси, пиротехнические составы и т.д. Легкие сплавы металлов Не смотря на то, что активно развивается производство полимерных материалов, использование самых легких металлов не стало второстепенным, объем производства только растет. Более всего это касается алюминия и его сплавов. Сплав алюминия и лития нашел широкое применение в авиакосмической промышленности. Этот сплав превосходит многие иные сплавы по ряду параметров, а так же может конкурировать с пластмассами, упроченными волокнами. Для обеспечения вязкости сплава в него вводят легирующие элементы: медь, марганец, цирконий. Алюмо-литиевые сплавы обладают необходимой жесткостью при малой плотности, благодаря чему незаменимы как материалы для легких конструкций. Велосипеды делают из легких алюмо-литиевых сплавов Велосипеды делают из легких алюмо-литиевых сплавов Сплавы магния многочисленны. У них высокая удельная прочность при весьма низкой плотности, что незаменимо для конструкционных материалов в авиакосмической технике. Магний придает сплавам легкость, делая их легче алюминия на треть. Алюминий и алюминиевые сплавы широко применяются во многих сферах, по распространенности они на второй позиции после железа и его сплавов. Однако алюминий не столь применим в чистом виде, сколько именно в сплавах. Они отличаются высокой коррозионной стойкостью, у них малая плотность, а так же очень высокие технологические свойства. Сплавы алюминия нашли применение в архитектуре, быту, судостроении, космической технике. Сплавы из легкого алюминия принимают в авиастроении Сплавы из легкого алюминия принимают в авиастроении Из сплавов алюминия с магнием и медью производят автомобильные детали и делали для авиационного производства. Есть жаропрочные и морозоустойчивые высокопрочные сплавы алюминия, использующиеся как декоративные и разнообразные защитные покрытия. В ядерном ракетостроении применяют циркалой, являющийся сплавом алюминия и циркония. Мощное взрывчатое вещество – алюмотол, одна из его составляющих – порошок алюминия. Легкий сплав циркалой применяют в ядерной промышленности Легкий сплав циркалой применяют в ядерной промышленности Самый легкий металл в мире Среди металлов есть очень легкие, это те, чья плотность не превышает пяти г/см3. Это литий, цезий, натрий, калий, алюминий, магний, кальций и барий. Самым легким из всех является литий 1л, плотность которого 0,534 г/см3. Как известно, этот металл даже не тонет в воде. Литий был открыт химиком Арфведсоном в 1817-ом году. Спустя семь лет литий вывели лабораторным путем. Внешне этот металл напоминает лед, даже имеет тот же серебристый оттенок, однако он пластичный и мягкий. Металл литий настолько легкий, что не тонет в воде Металл литий настолько легкий, что не тонет в воде В чистом виде этот легкий металл не используется, так как активно взаимодействует с окружающей его средой. Обычно литий сплавляют с натрием или другими металлами. Без лития не обходятся при изготовлении пиротехники, в оптике, в термоядерном оружии, в качестве окислителя. Так же без него не обходятся в фармацевтике, пищевой, текстильной и силикатной промышленности. Некоторые сплавы лития оказались полезными в авиа-космической промышленности и электронике. Легкий литий используется в высокотехнологичных отраслях Легкий литий используется в высокотехнологичных отраслях Ну а в список самых твердых металлов литий и натрий не выходят. По данным uznayvse.ru, самый твердый металл это титан.
Люди научились использовать полезные свойства самых легких металлов. Некоторые из них применяют в чистом виде, однако сфера применения легких сплавов металлов гораздо более обширна. Где используют самые легкие металлы? Известно, что самый легкий металл – литий. Однако существует металл, который еще легче. Таковым является микролаттис. Он был получен учеными Калифорнийского университета. Этот сверхлегкий твердый металл в сотню раз легче пенополистирола. Литий самый легкий металл из таблицы Менделеева Литий самый легкий металл из таблицы Менделеева Кусочек микролаттиса, положенный на одуванчик, его даже не деформирует. Данный металл способен выдерживать колоссальные нагрузки для своего веса. Благодаря таким свойствам, его применяют во многих сферах жизнедеятельности человека: используют при производстве электродов для батарей, в аэрокосмической промышленности и автопромышленности для звуко- и теплоизоляции. Микролаттис самый легкий металл в мире Микролаттис самый легкий металл в мире Литий широко применим в сплавах. Используют его при изготовлении анодов химических источников тока, оптики, высокоэффективных лазеров. При приготовлении электролита щелочных аккумуляторов в качестве одного из компонентов используют гидроксид лития. Взяв за основу силикат и алюминат лития, создали керамику, которая способна застыть при комнатной температуре, что стало незаменимо в металлургии, военной технике, а в будущем и в термоядерной энергетике. Соли лития успешно применяются в медицине, чаще им лечат психические заболевания. Так, карбонат лития способен стабилизировать настроение людей. В текстильной промышленности с помощью соединений лития происходит процесс отбеливания тканей. Без лития не обходится пищевая промышленность и фармацевтика. Легкий металл алюминий применяется во многих отраслях Легкий металл алюминий применяется во многих отраслях В конструкционных материалах не обходятся без бериллия и магния, а вот кальций и стронций, притом, что они легче алюминия, почти не используются. Бериллий не только очень легкий металл, но и редкий, а следовательно дорогой. Кроме того, он токсичен. Бериллий применяют в тех сферах, где он незаменим, в том числе в космической промышленности. Еще один металл из разряда самых легких – алюминий. Он получил звание металла двадцатого века. Область его применения весьма широка. Из него производят строительные конструкции, алюминиевую фольгу, электропровода, консервные банки, взрывчатые смеси, пиротехнические составы и т.д. Легкие сплавы металлов Не смотря на то, что активно развивается производство полимерных материалов, использование самых легких металлов не стало второстепенным, объем производства только растет. Более всего это касается алюминия и его сплавов. Сплав алюминия и лития нашел широкое применение в авиакосмической промышленности. Этот сплав превосходит многие иные сплавы по ряду параметров, а так же может конкурировать с пластмассами, упроченными волокнами. Для обеспечения вязкости сплава в него вводят легирующие элементы: медь, марганец, цирконий. Алюмо-литиевые сплавы обладают необходимой жесткостью при малой плотности, благодаря чему незаменимы как материалы для легких конструкций. Велосипеды делают из легких алюмо-литиевых сплавов Велосипеды делают из легких алюмо-литиевых сплавов Сплавы магния многочисленны. У них высокая удельная прочность при весьма низкой плотности, что незаменимо для конструкционных материалов в авиакосмической технике. Магний придает сплавам легкость, делая их легче алюминия на треть. Алюминий и алюминиевые сплавы широко применяются во многих сферах, по распространенности они на второй позиции после железа и его сплавов. Однако алюминий не столь применим в чистом виде, сколько именно в сплавах. Они отличаются высокой коррозионной стойкостью, у них малая плотность, а так же очень высокие технологические свойства. Сплавы алюминия нашли применение в архитектуре, быту, судостроении, космической технике. Сплавы из легкого алюминия принимают в авиастроении Сплавы из легкого алюминия принимают в авиастроении Из сплавов алюминия с магнием и медью производят автомобильные детали и делали для авиационного производства. Есть жаропрочные и морозоустойчивые высокопрочные сплавы алюминия, использующиеся как декоративные и разнообразные защитные покрытия. В ядерном ракетостроении применяют циркалой, являющийся сплавом алюминия и циркония. Мощное взрывчатое вещество – алюмотол, одна из его составляющих – порошок алюминия. Легкий сплав циркалой применяют в ядерной промышленности Легкий сплав циркалой применяют в ядерной промышленности Самый легкий металл в мире Среди металлов есть очень легкие, это те, чья плотность не превышает пяти г/см3. Это литий, цезий, натрий, калий, алюминий, магний, кальций и барий. Самым легким из всех является литий 1л, плотность которого 0,534 г/см3. Как известно, этот металл даже не тонет в воде. Литий был открыт химиком Арфведсоном в 1817-ом году. Спустя семь лет литий вывели лабораторным путем. Внешне этот металл напоминает лед, даже имеет тот же серебристый оттенок, однако он пластичный и мягкий. Металл литий настолько легкий, что не тонет в воде Металл литий настолько легкий, что не тонет в воде В чистом виде этот легкий металл не используется, так как активно взаимодействует с окружающей его средой. Обычно литий сплавляют с натрием или другими металлами. Без лития не обходятся при изготовлении пиротехники, в оптике, в термоядерном оружии, в качестве окислителя. Так же без него не обходятся в фармацевтике, пищевой, текстильной и силикатной промышленности. Некоторые сплавы лития оказались полезными в авиа-космической промышленности и электронике. Легкий литий используется в высокотехнологичных отраслях Легкий литий используется в высокотехнологичных отраслях Ну а в список самых твердых металлов литий и натрий не выходят. По данным uznayvse.ru, самый твердый металл это титан.
Легкий металл — Большая Энциклопедия Нефти и Газа, статья, страница 1
Легкий металл
Легкие металлы плавятся при сравнительно невысоких температурах; что же касается тяжелых металлов, то среди них находятся самые тугоплавкие. Особенно тугоплавок металл вольфрам, из которого делают нити для электрических лампочек. [1]
Легкие металлы , такие как алюминий и магний, получают, разлагая соли, чаще всего хлориды, электрическим током. Таким образом производят алюминий, магний и щелочные металлы. Титан и цирконий получают также электролизом или восстановлением соединений металла с помощью магния или натрия. [2]
Легкие металлы вытесняют старые цветные металлы. [3]
Легкие металлы , такие как алюминий и магний, получают, разлагая соли, чаще всего хлориды, электрическим током. Таким образом производят алюминий, магний и щелочные металлы. Титан и цирконий получают также электролизом или восстановлением соединений металла с помощью магния или натрия. [4]
Легкие металлы — алюминий, магний и их сплавы широко применяются в промышленности. [5]
Легкие металлы ( А1 и Mg) получили применение в качестве технических металлов сравнительно недавно, когда были выработаны способы получения их в большом масшабе путем электролиза расплавленных солей. Особенно большое значение приобрел алюминий, который по некоторым качествам и распространенности в природе превосходит даже железо. [6]
Легкие металлы обычно не получают восстановлением углеродом, так как это ведет к большому расходу энергии и, кроме того, чистые металлы начинают выделяться из соединений только при высокой температуре в парообразной фазе. Отделение паров легких металлов от газообразных окислов углерода сопряжено с большими трудностями и хотя технически возможно, но экономически пока не целесообразно. Некоторые пути частичного решения этой проблемы излагаются в данной книге. [7]
Легкие металлы , как правило, легко плавятся. [8]
Обычно легкие металлы встречаются в виде солей соляной, серной, угольной и фосфорной кислот. Руды тяжелых металлов представляют собой оксиды, сульфиды и карбонаты. [9]
Остальные легкие металлы пока применяют в небольших количествах, поэтому в данной книге подробно описываются лишь способы получения алюминия и магния. [10]
Легкий металл серебристо-белого цвета , гибкий, ковкий, твердый, но мало вязкий. [11]
Легкими металлами принято называть цветные металлы, имеющие небольшую плотность. [12]
Самые легкие металлы из лантанидов ( La, Ce, Pr, Nd, Gd) получают восстановлением их трихлоридов кальцием при температурах от 1000 и выше. Для получения остальных металлов ( Tb, Dy, Но, Er, Tm, а также Y) используют трифториды, так как хлориды слишком летучи. Рт получают восстановлением PmF3 металлическим литием. [14]
Когда легкие металлы и их соединения, всплывшие на поверхность, застыли, они образовали как бы скорлупу вокруг раскаленной жидкой магмы. Этот огненно-жидкий расплав еще и сейчас временами вырывается наружу во время вулканических извержений. Когда же верхний слой земли затвердел, температура на ее поверхности упала. [15]
Разработан самый легкий в мире металл
Секрет материала в его ячеистой структуре, которая образована из полых трубок, расположенных крест-накрест. В итоге материал стал невероятно легким, а также способным выдерживать большое давление, поглощая больше энергии, чем другие металлы. Научный сотрудник лаборатории HRL София Янг говорит, что такую же структуру имеют кости. Внешняя часть костей очень жесткая, тогда как изнутри большинство наших костей полые и обладают в основном ячеистой структурой, а потому они не так легко ломаются и при этом мало весят. Подобные трехмерные полимеры с открытопористой структорой – это самые легкие материалы в мире. Их полезные свойства демонстрируются на примере школьной задачки — как сохранить яйцо неповрежденным при падении с 25 этажа. Если обернуть яйцо несколькими слоями пузырчатой пленки, то оно разобьется, а вот микролаттис как раз его убережет, поглотив силу удара.
«Одним из самых потенциальных применений микролаттиса, на наш взгляд, является его использование в качестве структурного компонента в аэрокосмической промышленности, – рассказывает София Янг. – Когда я сажусь в самолет и прислоняюсь к боковой панели, когда кладу багаж на багажную полку или иду по половым панелям воздушного судна, я думаю о том, что микролаттис может быть использован в любом из этих случаев».
Компания Boeing заявляет, что готова применить микролаттис уже в ближайшем будущем. Материал позволит значительно облегчить вес самолетов, вследствие чего уменьшится потребление топлива.
Удивила разработка ученых? Поделитесь с друзьями! Просто нажмите на одну из кнопок соцсетей ниже ↓
список, названия, классификация и использование :: BusinessMan.ru
Ведущей отраслью в экономике нашей страны является металлургия. Для успешного ее развития нужно много металла. В данной статье речь пойдет о цветных тяжелых и легких металлах и их использовании.
Классификация цветных металлов
В зависимости от физических свойств и назначения, они подразделяются на такие группы:
- Легкие цветные металлы. Список этой группы большой: в ее состав входит кальций, стронций, цезий, калий, а также литий. Но в металлургической промышленности чаще всего используются алюминий, титан и магний.
- Тяжелые металлы пользуются большой популярностью. Это всем известные цинк и олово, медь и свинец, а также никель.

- Благородные металлы, такие как платина, рутений, палладий, осмий, родий. Золото и серебро широко применяются для изготовления украшений.
- Редкоземельные металлы — селен и цирконий, германий и лантан, неодим, тербий, самарий и другие.
- Тугоплавкие металлы — ванадий и вольфрам, тантал и молибден, хром и марганец.
- Малые металлы, такие как висмут, кобальт, мышьяк, кадмий, ртуть.
- Сплавы – латунь и бронза.
Легкие металлы
Они имеют широкое распространение в природе. Эти металлы обладают маленькой плотностью. У них высокая химическая активность. Они представляют собой прочные соединения. Металлургия этих металлов начала развиваться в девятнадцатом веке. Их получают путем электролиза солей в расплавленном виде, электротермии и металлотермии. Легкие цветные металлы, список которых имеет много пунктов, используются для производства сплавов.
Алюминий
Относится к легким металлам. Имеет серебристый цвет и точку плавления около семисот градусов. В промышленных условиях используется в сплавах. Он применяется везде, где нужен металл. У алюминия плотность низкая, а прочность – высокая. Этот металл легко режется, пилится, сваривается, сверлится, паяется и сгибается.

Сплавы образует с металлами различных свойств, такими как медь, никель, магний, кремний. Они обладают большой прочностью, не ржавеют при неблагоприятных погодных условиях. У алюминия высокая электро- и теплопроводность.
Магний
Он относится к группе легких цветных металлов. Имеет серебристо-белый цвет и пленочное окисное покрытие. Обладает маленькой плотностью, хорошо обрабатывается. Металл устойчив к воздействию горючими веществами: бензином, керосином, минеральными маслами, но подвержен растворению в кислотах. Магний не магнитен. Обладает низкими упругими и литейными свойствами, подвергается коррозии.
Титан
Это легкий металл. Он не магнитен. Имеет серебристый цвет с отливом голубоватого тона. Обладает высокой прочностью и устойчивостью к коррозии. Но у титана маленькая электропроводность и теплопроводность. Теряет механические свойства при температуре 400 градусов, приобретает хрупкость при 540 градусах.

Механические свойства титана повышаются в сплавах с молибденом, марганцем, алюминием, хромом и другими. В зависимости от легирующего металла, сплавы имеют разную прочность, среди них есть и высокопрочные. Такие сплавы применяются в самолетостроении, машиностроении, судостроении. Из них производят ракетную технику, бытовые приборы и многое другое.
Тяжелые металлы
Тяжелые цветные металлы, список которых весьма широк, получают из сульфидных и окисленных полиметаллических руд. В зависимости от их типов, методы получения металлов отличаются по способу и сложности производства, в процессе которого должны полностью извлекаться ценные составляющие сырья.
Металлы этой группы бывают гидрометаллургическими и пирометаллургическими. Полученные любым методом металлы называются черновыми. Они подвергаются процедуре рафинирования. Только после этого их можно использовать в промышленных целях.
Цветные металлы, список которых представлен выше, в промышленности используются не все. В данном случае речь идет о распространенном тяжелом металле – меди. У нее высокая теплопроводность, электропроводность и пластичность.

Сплавы меди нашли широкое применение в такой отрасли промышленности, как машиностроение, а все благодаря тому, что этот тяжелый металл хорошо сплавляется с другими.
Он тоже представляет цветные металлы. Список названий большой. Однако далеко не все тяжелые цветные металлы, к которым относится цинк, используются в промышленности. Этот металл хрупкий. Но если нагреть его до ста пятидесяти градусов, он будет без проблем коваться и с легкостью прокатываться. У цинка высокие антикоррозионные свойства, но он поддается разрушению при воздействии щелочью и кислотой.
Свинец
Список цветных металлов будет неполным без свинца. Он серого цвета с проблеском голубого оттенка. Температура плавления составляет триста двадцать семь градусов. Он тяжелый и мягкий. Хорошо куется молотком, при этом не твердеет. Из него выливают различные формы. Устойчив к воздействию кислот: соляной, серной, уксусной, азотной.
Латуни
Это сплавы из меди и цинка с добавлением марганца, свинца, алюминия и других металлов. Стоимость латуни меньше, чем меди, а прочность, вязкость и коррозионная стойкость – выше. У латуни хорошие литейные свойства. Из нее производят детали путем штамповки, раскатки, вытяжки, вальцовки. Из этого металла делают гильзы для снарядов и многое другое.
Использование цветных металлов
Цветными называют не только сами металлы, но и их сплавы. Исключение составляет так называемый «чермет»: железо и, соответственно, его сплавы. В странах Европы цветные металлы носят название нежелезистых. Цветные металлы, список которых немаленький, нашли широкое применение в разных отраслях во всем мире, в том числе и в России, где являются основной специализацией. Производятся и добываются на территориях всех регионов страны. Легкие и тяжелые цветные металлы, список которых представлен большим разнообразием наименований, составляют отрасль промышленности под названием «Металлургия». Это понятие включает в себя добычу, обогащение руд, выплавку как металлов, так и их сплавов.

В настоящее время отрасль цветной металлургии получила широкое распространение. Качество цветных металлов очень высокое, они отличаются долговечностью и практичностью, применяются в строительной индустрии: ими отделывают здания и сооружения. Из них производят профильный металл, проволоку, ленты, полосы, фольгу, листы, прутки различной формы.
Сплавы металлов и их применение
В настоящее время находят практическое применение почти все металлы или в чистом виде, или в виде сплавов друг с другом. Это применение целиком определяется теми или иными свойствами металлов и их сплавов. Ниже приводится краткий перечень металлов и их сплавов, которые находят наиболее широкое применение или обладают особо ценными свойствами. Наиболее широко применяется железо и алюминий, а также их сплавы (см. часть IX и часть X).
Медь. Чистая медь благодаря большой электропроводности, уступающей только серебру, широко применяется для изготовления электрических проводов и радиотехнической аппаратуры. Тонкие провода изготовляются из бес кислородной меди (кислорода не более 0,02%), так как кислород сообщает меди хрупкость. Иногда к электротехнической меди в небольших количествах добавляют некоторые металлы, повышающие ее прочность, но не снижающие электропроводности, например кадмий (до 1%).
Сплавы меди с цинком называются латунями, а с другими металлами называются бронзами.
Алюминиевые бронзы (5—11% А1) обладают высокой коррозионной стойкостью и золотистым блеском. Они идут на изготовление лент, пружин, шестерен и художественных изделий. Кремнистые бронзы (4—5% Si) обладают высокими механическими и антикоррозионными свойствами. Они применяются в химической промышленности для изготовления сеток,’ проводов, трубопроводов. Берил-лиевые бронзы (1,8—2,3% Be) способны при быстром охлаждении с 800° принимать закалку и становятся твердыми и упругими, как сталь. Их применяют главным образом при изготовлении часовых механизмов и в точной механике. Большинство бронз имеет сложный состав и являются трех- или четырех компонентными сплавами.
Сплавы меди, содержащие до 10% цинка, называются томпаком; при большем содержании цинка (10—40%) — латунью. Томпак и латунь хорошо прокатываются и обрабатываются штамповкой и прессованием. Они применяются для изготовления листов, труб, патронных гильз и различной арматуры (краны, вентили и др.). Добавление в латунь олова резко улучшает ее коррозионную стойкость («морская» латунь).
Сплавы меди с никелем (иногда с добавлением цинка) обладают значительным сопротивлением. Некоторые из них, например мельхиор, применяются для изготовления предметов домашнего обихода. К этим сплавам относятся: манганин — 85% Си, 12% Мп, 3% N; нейзильбер — 65% Си, 20% Z, 15% N; константан — 59% Си, 40% N, 1% Мп; мельхиор — 80% Си, 20% N.
Цинк. Чистый цинк благодаря высокой коррозионной стойкости используется главным образом для цинкования железа (горячим или электролитическим способом). Значительная часть его расходуется на производство сплавов, главным образом с медью.
Ртуть, являющаяся при обычных условиях единственным жидким металлом, применяется в электротехнической промышленности для изготовления ртутных выпрямителей, ртутных прерывателей и для изготовления термометров.
Германий в чистом виде почти не имеет собственных носителей электрического тока (электронов), и в этом отношении он близок к неметаллам. Обладая полупроводниковыми свойствами, он применяется в электро- и радиотехнике для устройства электрических выпрямителей. Пластинка германия размером в несколько миллиметров заменяет радиолампу.
Олово благодаря высокой коррозионной стойкости применяется для лужения железа. Используют его для приготовления подшипниковых и легкоплавких сплавов.
Свинец в большом количестве идет на изготовление оболочек кабелей (примесей не больше 0,08—0,14%), подшипниковых сплавов, пластин аккумуляторов, применяется также в ядерной технике и на покрытие поверхности аппаратов в химической промышленности.
Титан и цирконий относятся к сравнительно легким металлам, обладающим высокой коррозионной стойкостью. По прочности они не уступают стали. До последнего времени титан относился к редким металлам, так как не было удовлетворительных способов получения его в чистом виде. Механической обработке поддается только чистый титан. Применяется он главным образом в самолетостроении, заменяя дуралюминий, который при сверхзвуковых скоростях самолетов благодаря нагреву начинает терять механические свойства. Весьма перспективно применение титана в морском деле — длительные (десятилетние) опыты показали, что он практически не подвергаем ся коррозии в морской воде.
Цирконий дороже титана. Он нашел применение в устройстве атомных реакторов в качестве коррозионностойкого материала, почти не задерживающего медленных нейтронов. Цирконий в нагретом состоянии весьма активен по отношению к кислороду, водороду, азоту и другим газам. Поэтому его применяют в качестве геттера — вещества, поглощающего газы. С этой целью из циркония делают держатели для вольфрамовых нитей радиоламп.
Ниобий и тантал обладают весьма высокой коррозионной стойкостью. Практически в кислотах, в том числе в смеси соляной и азотной кислот, за исключением плавиковой, они не растворяются. Эти металлы, особенно тантал, находят применение в химической промышленности для замены платины при работе с агрессивными средами. Благодаря высокой теплопроводности, превосходящей таковую железа в 17 раз, тантал весьма пригоден для устройства теплообменников. При одинаковой конструкции и производительности теплообменник из тантала меньше железного примерно в 17 раз. Широкому применению тантала еще мешает его высокая стоимость.
Хром благодаря своей высокой коррозионной стойкости и стойкости против истирания применяется для получения защитных покрытий на железе и меди. Изделия из хрома не изготовляются вследствие его хрупкости. Он входит в состав различных сплавов с железом.
Молибден и вольфрам являются самыми тугоплавкими металлами. Они применяются в виде проволок (особенно вольфрам) при изготовлении нитей накаливания электроламп, высокотемпературных печей. Печи с вольфрамовой обмоткой развивают температуру до 2000—2500°. Благодаря большому сродству вольфрама с кислородом при высоких температурах обмотка должна находиться в восстановительной атмосфере, например водорода. В значительных количествах порошкообразный вольфрам идет на изготовление твердых сплавов на основе карбида вольфрама WC. Порошок карбида смешивается с порошком кобальта, и эта смесь прокаливается под давлением в атмосфере водорода. Получающийся материал (победит) идет на изготовление резцов, которые по сравнению со стальными резцами позволяют увеличить скорость обработки металлов примерно в 200 раз.
Применение металла в промышленности
Применение металла в промышленности
Металл является одним из самых необходимых материалов в промышленности, строительстве, сельском хозяйстве и иных видах жизнедеятельности человека. Несмотря на то, что сегодня все более популярным материалом становится пластик, трубы из него могут использоваться только в помещениях, а конструкции, проходящие под землей, можно изготавливать только из металла.
Чаще всего в промышленности и строительстве используются не чистые металлы, а их сплавы, в основе которых лежит какой-либо элемент и разнообразные добавки, улучшающие его качества – надежность, прочность и т.д. Самыми распространенными сплавами являются сталь, чугун, а также материалы, в основе которых лежит медь и алюминий.
Сталь является самым востребованным металлом. Подобный вывод можно сделать, проанализировав ежегодные объемы производства того или иного металла. В большинстве случаев, сталь представляет собой сплав железа с углеродом, количество которого достигает двух процентов. Сплавы стали подразделяются на несколько видов: малоуглеродистые, уровень углерода в которых не превышает 0,25%, высокоуглеродистые с содержанием углерода свыше 0,55% и легированные, дополненные никелем, хромом, ванадием. Для того чтобы значение стали в жизни человека стало для вас более явным, попробуйте вспомнить все металлические предметы, которые вы использовали за день, — ножи, бритву и т.д. все они изготовлены из стали.
На втором месте по объему производства находится чугун, который также представляет собой сплав железа и углерода. Только в отличие от стали, количество последнего в чугуне несколько больше. Для придания сплаву прочности в чугун добавляется кремний. Особенно широкое распространение чугун получил в строительстве: он используется для изготовления трубопроводной арматуры, крышек люков и других элементов, основным требованием которых является прочность. Кроме этого, из чугуна производится и некоторая посуда: так, в советское время у каждой хозяйки на кухне была сковорода из чугуна.
Хотя сплавы из алюминия не так распространены, как материалы, названные выше, некоторые их достоинства делают их незаменимыми для некоторых операций. Прежде всего, сплавы из алюминия отличает экономичность, легкость в обработке и другом использовании, а также легкодоступность. Такие сплавы без труда поддаются ковке, сварке, штампованию и другим подобным операциям, а также хорошо поддаются обработке на металлорежущих станках.
Использование алюминиевых сплавов ограничено лишь тем, что при высоких температурах они теряют ряд своих свойств. Так, температура двести градусов по Цельсию уже является для них высокой, между тем, как термоустойчивость – это очень важное свойство металла. К достоинствам алюминиевых сплавов относится их безвредность и экологичность, благодаря чему их можно использовать даже для хранения и перевозки пищевых продуктов, стойкость к появлению коррозии, высокая отражательная способность, а также немагнитность. Наиболее часто алюминиевые сплавы применяются в пищевой промышленности и машиностроении. Кроме этого, они необходимы для создания высоковольтных линий и изготовления некоторых архитектурно-отделочных материалов.
Большинство крупных машиностроительных и других промышленных предприятий, а также строительных фирм не работает непосредственно с металлом, покупает необходимый для их производства металлопрокат, изготовляемый металлургическими заводами, согласно ГОСТам или по индивидуальным чертежам заказчика.
Роль металлов в современной технике очень велика. Они широко используются во многих областях народного хозяйства, в т.ч. в тяжёлой отрасли промышленности, станкостроение, в производстве машин и механизмов, в авиационной и автомобильной отраслях промышленности, в космической технике. Наиболее широкое применение имеют железо и алюминий.
Применение алюминия
1.При получение лёгких сплавов (дюралюминий- в авиа-и ракетостроении, в строительстве).
2. В металлургии˸ для восстановления металлов из их оксидов ( алюминотермия).
3. При изготовлении электрических проводов и кабелей ( легче, чем провода из меди).
4.В производстве бытовых предметов.
Применение железа
1.При изготовлении электромагнитов, трансформаторов, электромоторов, мембран микрофонов ( благодаря способности в быстрому намагничиванию и размагничиванию).
2.Основная масса железа используется в виде железоуглеродистых сплавов – чугуна и стали, широко используемых в промышленности.
Применение меди
1.При изготовлении электрических проводов и кабелей ( хороший проводник тока).
2. Как компонент сплавов ( латуней, бронзы и др.).
Применение цинка
1.Как антикоррозионное покрытие от электрохимической коррозии ( благодаря химической активности).
2. Получение технически важных ( высокопластичных) сплавов˸ с Cu ( латуни), с AI и Ni.
3.Производство гальванических элементов ( цинковоугольных).
Применение титана
1.При получении сплавов (титан и ᴇᴦο сплавы обладают большой легкостью, прочностью , термической и коррозионной устойчивостью).
2.В авиа- и ракетостроении ,при строительстве подводных лодок.
3.В морском судостроении для изготовлении обшивки корпусов судов ,обладающих высокой прочностью и стойкостью в морской воде.
4.Как конструкционный материал при изготовлении оборудования для химической ,текстильной и бумажной отраслей промышленности.
Применение хрома
1.В производстве высококачественных твердых сталей (феррохром).
2.При изготовлении металлорежущих инструментов.
3.Как компонент нержавеющих сталей и сплавов.
4.Как антикоррозионное покрытие (хромирование стальных изделий для предотвращения коррозии).
Применение никеля
1.Как компонент легированных сталей ,а так же жаростойких ,сверхтвердых антикоррозионных и других сплавов.
2.Никелирование поверхностей предметов (от коррозии).
3.Как конструкционный материал при изготовлении химической аппаратурой и ядерных реакторов.
Вопрос 3.Сколько литров кислорода и воздуха нужно для полного сгорания 100 л смеси ,состоящий из 10 % метана , 20% пропана и 70% оксида углерода (II)?
Ответ.
V(смеси)= 100 л, V (O2) = ?
ω (Ch5 )= 10 %, V (возд.)= ?
V (Ch5) = 100 *10 /100 = 10 л,
V (C3 H8) =100*20/100= 20 л,
V (CO) = 100*70/100= 70 л.
Ch5 + 2O2 = CO2 ↑+2h3O.
V ˸ 1 моль 2 моль
C3H8 + 5O2= 3CO2↑+ 4h3O.
1. подготовка произ-ва
2. собственно произ-во изделия
Под технологической обработкой понимается комплекс следующих работ:
1. Анализ технологичности конструкции нового изделия.
— анализ возможностей изготовления нов. изделия средствами существующего произ-ва
2. Анализ сертификации.
— составление ведомости покупных, заимствованных и оригинальных деталей
3. Составление расцеховки изделия.
— Т.е. перечень цехов, чз которые должен пройти заказ
— определяется загрузка каждого цеха и требуемое расширение мощности
4. Проектирование технологического процесса, изготовление и сборка изделий.
5. Анализ средств технологич. оснащения:
— закупка на стороне нового оборудования
— использование существующих средств и их обработка
— проектирование изготовления новых средств оснащения.
6. Доработка изготовлен. спец. средств тех. оснащения.
7. Разработка новой планировки участков и цехов.
8. Отладка технологии и оснащения на опытной партии изделия.
Подсчитывается акт о сдаче пр-ва в технологическую эксплуатацию. Подготовка занимает от 1 до 7 лет, сейчас сокращают от 1до 5. Подготовку ограничивает НТП. Подготовка использует автоматизацию.
№9. Свойства металлов и сплавов, применяемых в машиностроении.
МЕХАНИЧЕСКИЕСВ-ВА – хар-ют способность материалов находиться под нагрузкой не разрушаясь и вместе с тем деформироваться (изменять форму и размеры). Внешняя нагрузка вызывает в тв. теле напряжение и деформацию.
Деформация – нагрузка, сила, отнесенная к единице сечения.
Напряжение – изменение размеров и формы тела под давлением приложенных сил (внешних).
Различают упругую дефформацию (исчезает после снятия нагрузки), пластичную (деформация остается после снятия нагрузки).
Колличественные значения механических свойств определяют в процессе испытаний на специальных разрывных машинах.
Прочность – способность тв. тела сопротивляться деформации и разрушению под действием внешних сил.
— предел прочности sв=Рмах/F0.знаменатель – исходное поперечное сечение, имер. Н/м2 или Мпа.
— Предел текучести sт=Рт/ F0.
Пластичность – способность материала получать остаточное изменение формы и размеров без разрушения.
Для стали sт=650МПа-низкая,650-1300-средняя,1300-1400-высокая прочность. Для алюминия dв=200-400 –средняя, для танталовых dв=800.
Твердость – способность материала сопротивляться проникновению другого тела.
Твердость по Бринеллю (НВ) – определяется путем вдавливания стального шарика под нагрузкой в поверхность испытуемого материала. После снятия нагрузки остается луночка, и по размеру луночки судят о твердости. Для стали НВ=150-200- средняя твердость.
Твердость по Роквеллу – в материал вдавливается алмазный конус, после вдавливания остается отпечаток. Угол конуса равен 1360 и вдавливают с разной силой (шкалы А, В, С, но используют шкалы А и С).
По шкале С оценивают твердость закаленных материалов HRC 20-70 среднее значение 45. По шкале А оценивают твердость тонких менее прочных инструментальных материалов HRA 70-85.
ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА.
Коэффициент линейного расширения, электропроводность, теплопроводность, окисление, намагничиваемость, удельная теплота плавления, коэффициент трения (возникает благодаря силам взаимодействия между молекулами и атомами соприкасающихся тел).
ТЕХНОЛОГИЧЕСКИЕ СВОЙСТВА.
Определяют способность материала подвергаться различным методам холодной и горячей обработки.
Жидкотекучесть – способность сплава наполнять форму.
Усадка – сокращение размеров и объема после остывания.
Ковкость – способность материала деформироваться при невысоком сопротивлении и принимать нужную форму без разрушения.
Сваривание – способность металлов образовывать прочные соединения при совместном расплавлении.
ЭКСПЛУАТАЦИОННЫЕ СВОЙСТВА.
Определяет долговечность материалов машине.
Хладноломкость – способность работать при минусовых температурах.
Жаростойкость – способность работать при высоких температурах.
Износостойкость – способность сопротивляться истиранию в процессе трения деталей друг о друга.
Циклическая прочность – вал разрушается при нагрузке в 3 и 5 раз меньше, чем в статическом состоянии.
№10. Черные металлы (чугуны и стали), Сортамент, основные виды, марки материалов.
Черными металлами является железо и его сплавы. На долю черных металлов приходится 95% мировой металлопродукции.
Чугун Fe+C (3-4,5%).
В его состав могут входить полезные Mn & Si и плохие составляющие S & P (вместе с коксом). Чугун делят на группы:
Серый чугун. (технический): СЧ32, где прочность -sв=32 кг/м2. Используют для изготовления рам и станин машин.
Ковкий чугун. (более прочный): КЧ17-32 соответственно прочность-sв и пластичность -d. Изготовляют крупные детали, работающих при динамичной нагрузке: маховики паровых машин.
Высокопрочный жаростойкий чугун (300-400оС): ЧС5 (Si – 5% придает высокую термостойкость)
Сталь – деформируемый ковкий сплав Fe+C (до 2%). Различают по химическому составу:
Углеродистые стали. (Mn 1%, Si 0.45%).
1.Углеродистая сталь обыкновенного качества: Ст0 до Ст6 (7 марок), наиболее известная Ст3, по мере увеличения цифры увеличивается содержание углерода и прочность-sв. Из нее изготавливают прокат:
Легкий цветной металл — Большая Энциклопедия Нефти и Газа, статья, страница 1
Легкий цветной металл
Легкие цветные металлы — алюминий, магний и бериллий отличаются не только малой плотностью ( до 2700 кг / м3), но и высокой химической активностью, теплоемкостью, теплопроводностью и электропроводимостью, что осложняет их сварку. Эти металлы имеют низкую температуру плавления ( особенно магний и алюминий), но при их окислении образуются чрезвычайно тугоплавкие и плотные ( тяжелые) оксиды, нерастворимые в металле и существенно затрудняющие процесс сварки. [1]
Подобно легким цветным металлам ( алюминию, магнию, кальцию), легкие редкие металлы получают электролизом расплавленных солей или металлотермическими способами. [2]
Растущая промышленность легких и цветных металлов , спе циальных сталей требует с каждым годом все большего количества высококачественного сырья для электродных заводов, что в свою очередь вызывает ( необходимость дальнейшего совершенствования процессов коксования смол. [3]
Алюминий относится к группе легких цветных металлов . После кислорода он является самым распространенным элементом в природе. [4]
Алюминий относится к числу важнейших легких цветных металлов . По масштабам производства и потребления он занимает второе место среди всех металлов ( после железа) и первое место среди цветных металлов. Поэтому в цветной металлургии производство этого металла выделено в отдельную специализированную подотрасль Алюминиевая промышленность включающую добычу сырья для алюминиевой промышленности, производство алюминия, глинозема и фтористых солей. [5]
Коррозионное растрескивание наблюдается также у легких цветных металлов и их сплавов ( сплав ы Al — — Mg) и медноцинковых сплавах. Легирование и термическая обработка существенно снижают склонность этих сплавов к коррозионному растрескиванию. [7]
За последние годы возросло потребление легких, цветных металлов и неметаллических материалов, в том числе пластмасс и других высокомолекулярных соединений. [8]
К цветной металлургии относится производство тяжелых и легких цветных металлов ( важнейшими из них являются медь, цинк, свинец, олово, алюминий, магний), редких и благородных металлов, механическая и термическая обработка их, а также переработка лома и отходов, содержащих эти металлы. Методы производства и переработки сырья в цветной металлургии значительно более разнообразны, чем в черной металлургии, что обусловлено рядом причин. Во-первых, цветные металлы содержатся в рудах в виде разнообразных соединений-сернистых, мышьяковистых, углекислых и др., тогда как железо находится в руде главным образом в виде окислов. Во-вторых, в большинстве руд цветные металлы содержатся в значительно меньших количествах, чем железо в железных рудах. Для рафинирования цветных металлов широко применяют электролиз. [9]
К цветной металлургии относится производство тяжелых и легких цветных металлов ( важнейшими из них являются медь, цинк, свинец, олово, алюминий, магний), редких и благородных металлов, механическая и термическая обработка их, а также переработка лома и отходов, содержащих эти металлы. Методы производства и переработки сырья в цветной металлургии значительно более разнообразны, чем в черной металлургии, что обусловлено рядом причин. Во-первых, цветные металлы содержатся в рудах в виде разнообразных соединений-сернистых, мышьяковистых, углекислых и др., тогда как железо находится в руде главным образом в виде окислов. Во-вторых, в большинстве руд цветные металлы содержатся в значительно меньших количествах, чем железо в железных рудах. Для рафинирования цветных металлов широко применяют электролиз. [10]
В случае чистовой обработки изделий из легких цветных металлов и сплавов, пластмасс, полупроводниковых материалов большой эффект в повышении точности и чистоты обработанной поверхности, увеличении производительности достигается при использовании инструментов, оснащенных алмазами. [11]
При обработке вязких, материалов ( легких и цветных металлов , низкоуглеродистых, конструкционных, легированных и нержавеющих сталей, титановых сплавов) там, где нарезание резьбы обычными метчиками затруднено, находят все более широкое применение бесстружечные метчики. Они не имеют стружечных канавок и режущих элементов и поэтому не нарезают, а выдавливают резьбу в предварительно просверленном отверстии. [12]
Алюминий — серебристо-белый пластичный металл, относящийся к легким цветным металлам . [13]
Для третьего типа кривых ( рис. 2, в, легкие цветные металлы , жаропрочные сплавы в определенном интервале температур) наклон прямой сохраняется вплоть до очень малого уровня напряжений. [15]
Какой самый легкий металл в мире?
 Титан – высокопрочный твердый металл, который сразу же привлек к себе внимание. Свойствами титана являются: высокая удельная прочность; стойкость к высоким температурам; низкая плотность; коррозийная стойкость; механическая и химическая стойкость. Титан применяется в военной промышленности, медицине авиации, кораблестроении, и других сферах производства.
Титан – высокопрочный твердый металл, который сразу же привлек к себе внимание. Свойствами титана являются: высокая удельная прочность; стойкость к высоким температурам; низкая плотность; коррозийная стойкость; механическая и химическая стойкость. Титан применяется в военной промышленности, медицине авиации, кораблестроении, и других сферах производства.
9 Уран
 Самый известный элемент, который считается одним из самых прочных металлов в мире, и в нормальных условиях представляет собой слабый радиоактивный металл. В природе находится как в свободном состоянии, так и в кислых осадочных породах. Он достаточно тяжел, широко распространен повсеместно и обладает парамагнитными свойствами, гибкостью, ковкостью, и относительной пластичностью. Уран применяется во многих сферах производства.
Самый известный элемент, который считается одним из самых прочных металлов в мире, и в нормальных условиях представляет собой слабый радиоактивный металл. В природе находится как в свободном состоянии, так и в кислых осадочных породах. Он достаточно тяжел, широко распространен повсеместно и обладает парамагнитными свойствами, гибкостью, ковкостью, и относительной пластичностью. Уран применяется во многих сферах производства.
8 Вольфрам
 Известен как самый тугоплавкий металл из всех существующих, и относится к самым прочным металлам в мире. Представляет собой твердый переходный элемент блестящего серебристо-серого цвета. Обладает высокой прочностью, отличной тугоплавкостью, стойкостью к химическим воздействиям. Благодаря своим свойствам поддается ковке, и вытягивается в тонкую нить. Известен в качестве вольфрамовой нити накаливания.
Известен как самый тугоплавкий металл из всех существующих, и относится к самым прочным металлам в мире. Представляет собой твердый переходный элемент блестящего серебристо-серого цвета. Обладает высокой прочностью, отличной тугоплавкостью, стойкостью к химическим воздействиям. Благодаря своим свойствам поддается ковке, и вытягивается в тонкую нить. Известен в качестве вольфрамовой нити накаливания.
7 Рений

Среди представителей данной группы считается переходным металлом высокой плотности серебристо-белого цвета. В природе встречается в чистом виде, однако встречается в молибденовом и медном сырье. Отличается высокой твердостью и плотностью, и имеет отличную тугоплавкость. Обладает повышенной прочностью, которая не теряется при многократных перепадах температур. Рений относится к дорогим металлам и имеет высокую стоимость. Используется в современной технике и электронике.
6 Осмий

Блестящий серебристо-белый металл со слегка голубоватым отливом, относится к платиновой группе и считается одним из самых прочных металлов в мире. Аналогично иридию имеет высокую атомную плотность высокую прочность и твердость. Поскольку осмий относится к платиновым металлам, имеет схожие с иридием свойства: тугоплавкость, твердость, хрупкость, стойкость к механическим воздействиям, а также к влиянию агрессивных сред. Нашел широкое применение в хирургии, электронной микроскопии, химической промышленности, ракетной технике, электронной аппаратуре.
5 Бериллий

Относится к группе металлов, и представляет собой элемент светло-серого цвета, обладающий относительной твердостью и высокой токсичностью. Благодаря своим уникальным свойствам бериллий применяется в самых различных сферах производства: ядерной энергетике; аэрокосмической технике; металлургии; лазерной технике; атомной энергетике. Из-за высокой твердости бериллий используется при производстве легирующих сплавов, огнеупорных материалов.
4 Хром
 Следующим среди самых прочных металлов в мире является хром – твердый, высокопрочный металл голубовато-белого цвета, стойкий к воздействию щелочей и кислот. В природе встречается в чистом виде и широко применяется в различных отраслях науки, техники и производства. Хром используется для создания различных сплавов, которые используются при изготовлении медицинского, а также химического технологического оборудования. В соединении с железом образует сплав феррохром, который используется при изготовлении металлорежущих инструментов.
Следующим среди самых прочных металлов в мире является хром – твердый, высокопрочный металл голубовато-белого цвета, стойкий к воздействию щелочей и кислот. В природе встречается в чистом виде и широко применяется в различных отраслях науки, техники и производства. Хром используется для создания различных сплавов, которые используются при изготовлении медицинского, а также химического технологического оборудования. В соединении с железом образует сплав феррохром, который используется при изготовлении металлорежущих инструментов.
3 Тантал
 Тантал является одним из самых прочных металлов в мире. Он представляет собой серебристый металл с высокой твердостью и атомной плотностью. Благодаря образованию на его поверхности оксидной пленки, имеет свинцовый оттенок. Отличительными свойствами тантала являются высокая прочность, тугоплавкость, стойкость к коррозии, воздействию агрессивных сред. Металл является достаточно пластичным металлом и легко поддается механической обработке. Сегодня тантал успешно используется: в химической промышленности; при сооружении ядерных реакторов; в металлургическом производстве; при создании жаропрочных сплавов.
Тантал является одним из самых прочных металлов в мире. Он представляет собой серебристый металл с высокой твердостью и атомной плотностью. Благодаря образованию на его поверхности оксидной пленки, имеет свинцовый оттенок. Отличительными свойствами тантала являются высокая прочность, тугоплавкость, стойкость к коррозии, воздействию агрессивных сред. Металл является достаточно пластичным металлом и легко поддается механической обработке. Сегодня тантал успешно используется: в химической промышленности; при сооружении ядерных реакторов; в металлургическом производстве; при создании жаропрочных сплавов.
2 Рутений

Рутений – серебристый металл, принадлежащий к платиновой группе. Его особенностью является наличие в составе мышечной ткани живых организмов. Ценными свойствами рутения являются высокая прочность, твердость, тугоплавкость, химическая стойкость, способность образовывать комплексные соединения. Рутений считается катализатором многих химических реакций, выступает в роли материала для изготовления электродов, контактов, острых наконечников.
1 Иридий
 Самый прочный металл – иридий – серебристо-белый, твердый и тугоплавкий, который относится к платиновой группе. В природе высокопрочный элемент встречается крайне редко, и часто входит в соединение с осмием. Из-за своей природной твердости он плохо поддается механической обработке и обладает высокой стойкостью к воздействию химический веществ. Иридий с большим трудом реагирует на воздействие галогенов и перекиси натрия. Этот металл играет важную роль в повседневной жизни. Его добавляют к титану, хрому и вольфраму для улучшения стойкости к кислым средам, применяют при изготовлении канцелярских принадлежностей, используют в ювелирном деле для создания ювелирных изделий. Стоимость иридия остается высокой из-за ограниченного присутствия в природе.
Самый прочный металл – иридий – серебристо-белый, твердый и тугоплавкий, который относится к платиновой группе. В природе высокопрочный элемент встречается крайне редко, и часто входит в соединение с осмием. Из-за своей природной твердости он плохо поддается механической обработке и обладает высокой стойкостью к воздействию химический веществ. Иридий с большим трудом реагирует на воздействие галогенов и перекиси натрия. Этот металл играет важную роль в повседневной жизни. Его добавляют к титану, хрому и вольфраму для улучшения стойкости к кислым средам, применяют при изготовлении канцелярских принадлежностей, используют в ювелирном деле для создания ювелирных изделий. Стоимость иридия остается высокой из-за ограниченного присутствия в природе.
ТОП-10 самых прочных металлов во всем мире
Применение металлов в обычной жизни началось с развития цивилизации. Первым была медь благодаря своей доступности в природе и легкой обрабатываемости.
Археологи постоянно раскапывают разные медные вещи из домашнего обихода.
В процессе развития человечества люди учились соединению различных металлов для получения наиболее прочных сплавов, которые станут пригодными для изготовления орудий труда, позднее оружия.
Рейтинг металлов
На сегодняшний день эксперименты не заканчиваются. С помощью них определяются прочнейшие металлы в мире.
На десятом месте оказался титан. Он является высокопрочным твердым металлом, мгновенно привлекшим собой внимание. Титан отличается
- высокой удельной прочностью,
- стойкостью к высоким температурным перепадам,
- низкой плотностью,
- стойкостью к коррозии, а также к механическим и химическим влияниям.
Титан используют в военной сфере, авиационной медицине, кораблестроении.

Девятую строчку занимает уран, считающимся известным элементом. Этот металл — один из прочных в мире. В обычной среде является слабым радиоактивным металлом.
В природе может быть и в свободном состоянии или находится в породах кислого осадочного типа.
Отличается достаточно тяжелым весом, распространен повсеместно и имеет парамагнитные свойства, гибкость, ковкость, относительную пластичность. Уран используют во многих производственных сферах.

Вольфрам знают как наиболее тугоплавкий металл из всех. Это самый прочный металл в мире. Является твердым переходным элементом, обладающим блестящим серебристо-серым оттенком. Имеет высокую прочность, отличную тугоплавкость, стойкостью к химвоздействиям. Из-за своих свойств поддается ковке. Его можно вытянуть в тонкую нить. Данный металл знаком как вольфрамовая нить накаливания.

Следующим в нашем рейтинге оказался рений. Среди этой группы это — переходный металл с высокой плотностью, имеющий серебристо-белый цвет. В природе можно встретить в чистом виде, но также и в молибденовом и медном сырье.
Среди его свойств можно выделить высокую твердость и плотность с отличной тугоплавкостью, повышенную прочность. Последнее качество не потеряется при множественных температурных перепадах. Рений — дорогой металл с высокой стоимостью.
Его применяют в современной технической и электронной сферах.

Шестое место занял осмий блестящего серебристо-белого цвета с голубоватым оттенком. Это родственник платиновой группы и один из прочнейших металлов в мире. Подобно иридию обладает
- высокой атомной плотностью,
- высокой прочностью и твердостью.
Так как осмий из семейства платиновых металлов, он похож на иридий по свойствам. Итак, он обладатель тугоплавкости, твердости, хрупкости, стойкости к воздействиям механического типа и агрессивным средам. Его широко применяют в хирургии, электронной микроскопии, химической сфере, ракетной технике, электронике.

На пятой строчке разместился бериллий. Имеет светло-серый цвет и относительную твердость, высокую токсичность.
За счет своих уникальных свойств бериллий используют в самых разных производствах: ядерная энергетика, аэрокосмическая и лазерная техника, металлургия, атомная энергетика.
Благодаря высоким показателям твердости бериллий применяют в изготовлении сплавов легирующего типа, огнеупорных материалов.

Следующим будет хром. Является твердым, высокопрочным металлом с голубовато-белым цветом. Обладает стойкостью к воздействию щелочей и кислот. В природе можно найти в чистом виде.
Известен широким использованием в различных научных, технических и производственных отраслях. С помощью хрома создают различные сплавы для медицинского, а также химического технологического оборудования.
Если соединить с железом, то получится феррохром. С помощью этого сплава изготавливают металлорежущие инструменты.

Итак, третье место. Бронзовую медаль заслужил тантал, так как это наиболее прочный металл из всех остальных. Металл имеет серебристый окрас и высокую твердость и атомную плотность. За счет образующейся на его поверхности оксидной пленки появляется свинцовый оттенок. Отличается тантал своей
- высокой прочностью,
- тугоплавкостью,
- антикоррозийной стойкостью и стойкостью к воздействиям агрессивных сред.
Это довольно пластичный металл, легко поддающийся механической обработке. На сегодняшний день тантал успешно применяют в следующих сферах: химическая промышленность, ядерные реакторы, металлургическое производство, создание жаропрочных сплавов.

Серебро завоевал рутений. Металл серебристого цвета из платиновой группы. Особенность его заключается в том, что в его составе содержится мышечная ткань живых организмов.
К ценным качествам рутения отнесем наличие высокой прочности, твердости, тугоплавкости, химической стойкости, способности к образованию комплексных соединений. Рутений выступает как катализатор немалого количества химических реакций.
Играет роль материала, с помощью которого изготавливают электроды, контакты, острые наконечники.

Лидер нашего рейтинга — иридий. Именно он возглавил десятку самых прочных металлов во всем мире. Серебристо-белого цвета, твердый и тугоплавкий металл из платиновой группы.
В природе данный высокопрочный элемент можно встретить иногда, но чаще всего он находится в соединении с осмием. Благодаря своей природной твердости он с трудом обрабатывается механически.
Имеет высокую стойкость к химическому воздействию.

Иридий дает плохую реакцию на галогены и перекись натрия. Данный металл занимает важное место в обыденной жизни. С помощью его добавления к титану, хрому и вольфраму улучшается стойкость к кислой среде, изготавливают канцелярские принадлежности, ювелирные изделия. Цена на иридий высока из-за ограниченности присутствия в природе.
Самый легкий металл • Наука

Самым лёгким из металлов, в периодической системе химических элементов Д. И. Менделеева, является Литий (лат. Lithium). Это элемент главной подгруппы первой группы, второго периода, с атомным номером 3.
Литий — мягкий щелочной металл серебристо-белого цвета, он был открыт в 1817 году шведским химиком А. Арфведсоном в минерале петалите (греч. lithos — камень). Металлический литий впервые получил Гемфри Дэви в 1825 году.
Изотопы Лития
Природный литий состоит из двух стабильных изотопов: 6Li (7,5 %) и 7Li (92,5 %); в некоторых образцах лития изотопное соотношение может быть сильно нарушено вследствие природного или искусственного фракционирования изотопов.
Это следует иметь в виду при точных химических опытах с использованием лития или его соединений. У лития известны 7 искусственных радиоактивных изотопов и два ядерных изомера (4Li − 12Li и 10m1Li − 10m2Li соответственно). Наиболее устойчивый из них, 8Li, имеет период полураспада 0,8403 с.
Экзотический изотоп 3Li (трипротон), по-видимому, не существует как связанная система.
7Li является одним из немногих изотопов, возникших при первичном нуклеосинтезе (то есть вскоре после Большого Взрыва). Образование элемента лития в звездах возможно по ядерной реакции «скалывания» более тяжелых элементов.
Распространение
Литий — типичный элемент земной коры (содержание 3,2·10-3% по массе), он накапливается в наиболее поздних продуктах дифференциации магмы — пегматитах. В мантии мало Лития — в ультраосновных породах всего 5·10-5% (в основных 1,5·10-3%, средних — 2·10-3%, кислых 4·10-3%).
Близость ионных радиусов Li+, Fe2+ и Mg2+ позволяет Литию входить в решетки магнезиально-железистых силикатов — пироксенов и амфиболов. В гранитоидах он содержится в виде изоморфной примеси в слюдах. Только в пегматитах и в биосфере известно 28 самостоятельных минералов Лития (силикаты, фосфаты и другие).
Все они редкие. В биосфере Литий мигрирует сравнительно слабо, роль его в живом веществе меньше, чем остальных щелочных металлов. Из вод он легко извлекается глинами, его относительно мало в Мировом океане (1,5·10-5%).
Промышленные месторождения Лития связаны как с магматическими породами (пегматиты, пневматолиты), так и с биосферой (соленые озера).

Литий — серебристо-белый металл, мягкий и пластичный, твёрже натрия, но мягче свинца. Его можно обрабатывать прессованием и прокаткой.
При комнатной температуре металлический литий имеет кубическую объёмноцентрированную решётку (координационное число 8), которая при холодной обработке переходит в кубическую плотноупакованную решётку, где каждый атом, имеющий двойную кубооктаэдрическую координацию, окружён 12 другими.
Ниже 78 К устойчивой кристаллической формой является гексагональная плотноупакованная структура, в которой каждый атом лития имеет 12 ближайших соседей, расположенных в вершинах кубооктаэдра.
Из всех щелочных металлов литий характеризуется самыми высокими температурами плавления и кипения (180,54 и 1340 °C, соответственно), у него самая низкая плотность при комнатной температуре среди всех металлов (0,533 г/см³, почти в два раза меньше плотности воды).
Маленькие размеры атома лития приводят к появлению особых свойств металла. Например, он смешивается с натрием только при температуре ниже 380° С и не смешивается с расплавленными калием, рубидием и цезием, в то время как другие па́ры щелочных металлов смешиваются друг с другом в любых соотношениях.
Конфигурация внешней электронной оболочки атома Лития 2s1; во всех известных соединениях он одновалентен.
При взаимодействии с кислородом или при нагревании на воздухе (горит голубым пламенем) Литий образует оксид Li2О (пероксид Li2O2 получается только косвенным путем).
С водой реагирует менее энергично, чем другие щелочные металлы, при этом образуются гидрооксид LiOH и водород. Минеральные кислоты энергично растворяют Li (стоит первым в ряду напряжений, его нормальный электродный потенциал — 3,02 в).
Литий соединяется с галогенами (с иодом при нагревании), образуя галогениды (важнейший — хлорид лития). При нагревании с серой Литий дает сульфид Li2S, а с водородом — гидрид лития.
С азотом Литий медленно реагирует уже при комнатной температуре, энергично — при 250 °С с образованием нитрида Li2N. С фосфором Литий непосредственно не взаимодействует, но в специальных условиях могут быть получены фосфиды.
Нагревание Лития с углеродом приводит к получению карбида Li2C2, скремнием- силицида Лития.
Бинарные соединения Литий — Li2О, LiH, Li3N, Li2C2, LiCl и другие, а также LiOH весьма реакционноспособны; при нагревании или плавлении они разрушают многие металлы, фарфор, кварц и другие материалы. Карбонат, фторид LiF, фосфат Li3PO4 и другие соединения Лития по условиям образования и свойствам близки к соответствующим производным магния и кальция.
Литий образует многочисленные литийорганические соединения, что определяет его большую роль в органическом синтезе.
Литий — компонент многих сплавов. С некоторыми металлами (Mg, Zn, Al) он образует твердые растворы значительной концентрации, со многими — интерметаллиды (LiAg, LiHg, LiMg2, LiAl и мн. других).
Последние часто весьма тверды и тугоплавки, незначительно изменяются на воздухе; некоторые из них — полупроводники.
Изучено ряд бинарных и тройных систем с участием Лития; соответствующие им сплавы уже нашли применение в технике.

Соединения Лития получаются в результате гидрометаллургической переработки концентратов — продуктов обогащения литиевых руд. Основной силикатный минерал — сподумен перерабатывают по известковому, сульфатному и сернокислотному методам. В основе первого — разложение сподумена известняком при 1150- 1200 °С:
- Li2O·Al2O3·4SiO2 + 8CaCO3 = Li2O·Al2O3 + 4(2CaO· SiO2) + 8CO2
- При выщелачивании спека водой в присутствии избытка извести алюминат Лития разлагается с образованием гидрооксида Лития:
- Li2O·Al2O3 + CaOH2 = 2LiOH + CaO·Al2O3
- По сульфатному методу сподумен (и другие алюмосиликаты) спекают с сульфатом калия:
- Li2O·Al2O3·4SiO2 + K2SO4 = Li2SO4 + K2O·Al2O3·4SiO2
- Сульфат Лития растворяют в воде и из его раствора содой осаждают карбонат Лития:

- Li2SO4+Na2CO3=Li2CO3 + Na2SO4.
- По сернокислотному методу также получают сначала раствор сульфата Лития, а затем карбонат Лития; сподумен разлагают серной кислотой при 250-300 °С (реакция применима только для β-модификации сподумена):
- β-Li2O·Al2O3·4SiO2 + H2SO4 = Li2SO4 + H2O·Al2O3·4SiO2
Метод используется для переработки руд, необогащенных сподуменом, если содержание в них Li2O не менее 1%. Фосфатные минералы Лития легко разлагаются кислотами, однако по более новым методам их разлагают смесью гипса и извести при 950-1050 °С с последующей водной обработкой спеков и осаждением из растворов карбоната Лития.
Металлический Литий получают электролизом расплавленной смеси хлоридов Лития и калия при 400-460 °С (весовое соотношение компонентов 1:1).
Электролизные ванны футеруются магнезитом, алундом, муллитом, тальком, графитом и других материалами, устойчивыми к расплавленному электролиту; анодом служат графитовые, а катодом — железные стержни.
Черновой металлический Литий содержит механические включения и примеси (К, Mg, Ca, Аl, Si, Fe, но главным образом Na). Включения удаляются переплавкой, примеси — рафинированием при пониженном давлении. В настоящее время большое внимание уделяется металлотермическим методам получения Лития.
Применение Лития. Важнейшая область применения Лития — ядерная энергетика. Изотоп 6Li — единственный промышленный источник для производства трития по реакции:
63Li + 10n = 31H + 42He
Важный редкий элемент

Сечения захвата тепловых нейтронов (σ) изотопами Лития резко различаются: 6Li 945,7Li 0,033; для естественной смеси 67 (в барнах); это важно в связи с техническим применением Лития — при изготовлении регулирующих стержней в системе защиты реакторов.
Жидкий Литий (в виде изотопа 7Li) используется в качестве теплоносителя в урановых реакторах. Расплавленный 7LiF применяется как растворитель соединений U и Th в гомогенных реакторах.
Крупнейшим потребителем соединений Лития является силикатная промышленность, в которой используют минералы Лития, LiF, Li2CO3 и многие специально получаемые соединения. В черной металлургии Литий, его соединения и сплавы широко применяют для раскисления, легирования и модифицирования многих марок сплавов.
В цветной металлургии литием обрабатывают сплавы для получения хорошей структуры, пластичности и высокого предела прочности.
Хорошо известны алюминиевые сплавы, содержащие всего 0,1% Лития,- аэрон и склерон; помимо легкости, они обладают высокой прочностью, пластичностью, стойкостью против коррозии и очень перспективны для авиастроения. Добавка 0,04% Лития к свинцово-кальциевым подшипниковым сплавам повышает их твердость и понижает трение. Соединения Лития используются для получения пластичных смазок. По значимости в современной технике Литий- один из важнейших редких элементов.
Литий в организме
Литий постоянно входит в состав живых организмов, однако его биологическая роль выяснена недостаточно. Установлено, что у растений Литий повышает устойчивость к болезням, усиливает фотохимическую активность хлоропластов в листьях (томаты) и синтез никотина (табак).
Способность концентрировать Литий сильнее всего выражена среди морских организмов у красных и бурых водорослей, а среди наземных растений — у представителей семейства Ranunculaceae (василистник, лютик) и семейства Solanaceae (дереза).
У животных Литий концентрируется главным образом в печени и легких.
Области применения лития
ПрименениеСплав сульфида лития и сульфида меди — эффективный полупроводник для термоэлектропреобразователей (ЭДС около 530 мкВ/К).
Из лития изготовляют аноды химических источников тока (аккумуляторов, например литий-хлорных аккумуляторов) и гальванических элементов с твёрдым электролитом (например, литий-хромсеребряный, литий-висмутатный, литий-окисномедный, литий-двуокисномарганцевый, литий-иодсвинцовый, литий-иодный, литий-тионилхлоридный, литий-оксидванадиевый, литий-фторомедный, литий-двуокисносерный элементы), работающих на основе неводных жидких и твёрдых электролитов (тетрагидрофуран, пропиленкарбонат, метилформиат, ацетонитрил).Кобальтат лития и молибдат лития показали лучшие эксплуатационные свойства и энергоёмкость в качестве положительного электрода литиевых аккумуляторов.Гидроксид лития используется как один из компонентов для приготовления электролита щелочных аккумуляторов. Добавление гидроксида лития к электролиту тяговых железо-никелевых, никель-кадмиевых, никель-цинковых аккумуляторных батарей повышает их срок службы в 3 раза и ёмкость на 21 % (за счёт образования никелатов лития).Монокристаллы фторида лития используются для изготовления высокоэффективных (КПД 80 %) лазеров на центрах свободной окраски, и для изготовления оптики с широкой спектральной полосой пропускания.Перхлорат лития используют в качестве окислителя.Сульфат лития используют в дефектоскопии.
- Нитрат лития используют в пиротехнике.
- Литий в машиностроении
Сплавы лития с серебром и золотом, а также медью являются очень эффективными припоями. Сплавы лития с магнием, скандием, медью, кадмием и алюминием — новые перспективные материалы в авиации и космонавтике. На основе алюмината и силиката лития создана керамика, затвердевающая при комнатной температуре и используемая в военной технике, металлургии, и, в перспективе, в термоядерной энергетике. Огромной прочностью обладает стекло на основе литий-алюминий-силиката, упрочняемого волокнами карбида кремния. Литий очень эффективно упрочняет сплавы свинца и придает им пластичность и стойкость против коррозии.
Триборат лития-цезия используется как оптический материал в радиоэлектронике. Кристаллические ниобат лития LiNbO3 и танталат лития LiTaO3 являются нелинейными оптическими материалами и широко применяются в нелинейной оптике, акустооптике и оптоэлектронике. Литий также используется при наполнении осветительных газоразрядных металлогалогеновых ламп.
В чёрной и цветной металлургии литий используется для раскисления и повышения пластичности и прочности сплавов. Литий иногда применяется для восстановления методами металлотермии редких металлов.
Карбонат лития является важнейшим вспомогательным веществом (добавляется в электролит) при выплавке алюминия и его потребление растет с каждым годом пропорционально объёму мировой добычи алюминия (расход карбоната лития 2,5-3,5 кг на тонну выплавляемого алюминия).Введение лития в систему легирования позволяет получить новые сплавы алюминия с высокой удельной прочностью.
Добавка лития снижает плотность сплава и повышает модуль упругости. При содержании лития до 1,8 % сплав имеет низкое сопротивление коррозии под напряжением, а при 1,9 % сплав не склонен к коррозионному растрескиванию. Увеличение содержания лития до 2,3 % способствует возрастанию вероятности образования рыхлот и трещин.
Механические свойства при этом изменяются: пределы прочности и текучести возрастают, а пластические свойства снижаются.Наиболее известны системы легирования Al-Mg-Li (пример — сплав 1420, применяемый для изготовления конструкций летательных аппаратов) и Al-Cu-Li (пример — сплав 1460, применяемый для изготовления емкостей для сжиженных газов).
Изотопы 6Li и 7Li обладают разными ядерными свойствами (сечение поглощения тепловых нейтронов, продукты реакций) и сфера их применения различна.
Гафниат лития входит в состав специальной эмали, предназначенной для захоронения высокоактивных ядерных отходов, содержащих плутоний.
Применяется в ядерных реакторах, использующих реакции с участием тяжёлых элементов, таких как уран, торий или плутоний.
Благодаря очень высокой удельной теплоёмкости и низкому сечению захвата тепловых нейтронов, жидкий литий-7 (часто в виде сплава с натрием или цезием-133) служит эффективным теплоносителем.
Фторид лития-7 в сплаве с фторидом бериллия (66 % LiF + 34 % BeF2) носит название «флайб» (FLiBe) и применяется как высокоэффективный теплоноситель и растворитель фторидов урана и тория в высокотемпературных жидкосолевых реакторах, и для производства трития.
Нестандартные способы применения
Соли лития обладают психотропным действием и используются в медицине при профилактике и лечении ряда психических заболеваний. Наиболее распространен в этом качестве карбонат лития. Применяется в психиатрии для стабилизации настроения людей, страдающих биполярным расстройством и частыми перепадами настроения. Он эффективен в предотвращении мании депрессии и уменьшает риск суицида.
Медики не раз наблюдали, что некоторые соединения лития (в соответствующих дозах, разумеется) оказывают положительное влияние на больных, страдающих маниакальной депрессией. Объясняют этот эффект двояко. С одной стороны, установлено, что литий способен регулировать активность некоторых ферментов, участвующих в переносе из межклеточной жидкости в клетки мозга ионов натрия и калия.
С другой стороны, замечено, что ионы лития непосредственно воздействуют на ионный баланс клетки. А от баланса натрия и калия зависит в значительной мере состояние больного: избыток натрия в клетках характерен для депрессивных пациентов, недостаток — для страдающих маниями. Выравнивая натрий калиевый баланс, соли лития оказывают положительное влияние и на тех, и на других.
Лития никотинат (литиевая соль никотиновой кислоты, литонит) используется как неспецифическое средство для лечения больных алкоголизмом, препарат улучшает метаболические процессы и гемодинамику, уменьшает аффективные растройства.Стеарат лития («литиевое мыло») используется в качестве высокотемпературной смазки.
Гидроксид лития LiOH, пероксид Li2O2 и супероксид LiO2 применяются для очистки воздуха от углекислого газа; при этом последние два соединения реагируют с выделением кислорода (например, 4LiO2 + 2CO2 → 2Li2CO3 + 3O2), благодаря чему они используются в изолирующих противогазах, в патронах для очистки воздуха на подлодках , на пилотируемых космических аппаратах и т. д.
Литий и его соединения широко применяют в силикатной промышленности для изготовления специальных сортов стекла и покрытия фарфоровых изделий.
- Соединения лития используются в текстильной промышленности (отбеливание тканей), пищевой (консервирование) и фармацевтической (изготовление косметики).
- Самыми же тяжёлыми металлами являются Осмий и Иридий.
По материалам chem100.ru, ru.wikipedia.org
Самые тяжелые металлы в мире

Металлы человечество начало активно использовать еще в 3000-4000 годах до нашей эры. Тогда люди познакомились с самыми распространенными из них, это золото, серебро, медь. Эти металлы было очень легко найти на поверхности земли. Чуть позже они познали химию и начали выделять из них такие виды как олово, свинец и железо. В Средневековье набирали популярность очень ядовитые виды металлов. В обиходе был мышьяк, которым было отравлено больше половины королевского двора во Франции. Так же и ртуть, которая помогала вылечить разные болезни тех времен, начиная от ангины и до чумы. Уже до двадцатого столетия было известно более 60 металлов, а вначале XXI века – 90. Прогресс не стоит на месте и ведет человечество вперед. Но встает вопрос, какой металл является тяжелым и превосходит по весу все остальные? И вообще, какие они, эти самые тяжелые металлы в мире?
Многие ошибочно думают, что золото и свинец являются самыми тяжелыми металлами.
Почему именно так сложилось? Многие из нас выросли на старых фильмах и видели, как главный герой использует свинцовую пластину для зашиты от злобных пуль.
В добавок, и сегодня используют свинцовые пластины в некоторых видах бронежилетов. А при слове золото у многих всплывает картинка с тяжелыми слитками этого металла. Но думать, что они самые тяжелые – ошибочно!
Для определения самого тяжелого металла надо брать во внимание его плотность, ведь чем больше плотность вещества, тем оно тяжелее.
ТОП-10 самых тяжелых металлов в мире
- Осмий (22,62 г/см3),
- Иридий (22,53 г/см3),
- Платина (21,44 г/см3),
- Рений (21,01 г/см3),
- Нептуний (20,48 г/см3),
- Плутоний (19,85 г/см3),
- Золото (19,85 г/см3)
- Вольфрам (19,21 г/см3),
- Уран (18,92 г/см3),
- Тантал (16,64 г/см3).
И где же свинец? А он располагается намного ниже в данном списке, в середине второго десятка.
Осмий и иридий — самые тяжелые металлы в мире
Рассмотрим основных тяжеловесов, которые делят 1 и 2 места. Начнем с иридия и заодно произнесём слова благодарности в адрес английского ученого Смитсона Теннат, который в 1803 году получил этот химический элемент из платины, где присутствовал вместе с осмием в виде примеси. Иридий с древнегреческого можно перевести, как «радуга».
Металл имеет белый цвет с серебряным оттенком и его можно назвать ни только тяжеловесным, но и самым прочным. На нашей планете его очень мало и за год его добывают всего до 10000 кг. Известно, что большинство месторождений иридия можно обнаружить на местах падения метеоритов.
Некоторые ученые приходят к мысли, что данный металл ранее был широко распространён на нашей планете, однако из-за своего веса, он постоянно выдавливал себя ближе к центру Земли. Иридий сейчас широко востребован в промышленности и используется для получения электрической энергии.
Так же его любят использовать палеонтологи, и с помощью иридия определяют возраст многих находок. Вдобавок, данный металл могут использовать для покрытия некоторых поверхностей. Но сделать это сложно.

Иридий
Далее рассмотрим осмий. Он самый тяжёлый в периодической таблице Менделеева, ну, соответственно, и самый тяжелый в мире металл. Осмий имеет оловянно-белый с синим оттенок и также открыт Смитсоном Теннат одновременно с иридием. Осмий практически невозможно обработать и, в основном, его находят на местах падения метеоритов.
Он неприятно пахнет, запах похож на смесь хлора и чеснока. И с древнегреческого переводится, как «запах». Металл довольно тугоплавкий и используется в лампочках и в других приборах с тугоплавкими металлами. За один только грамм этого элемента надо заплатить более 10000 долларов, из этого понятно, что метал очень редкий.

Осмий
Как не крути, самые тяжелые металлы являются большой редкостью и поэтому они дорого стоят. И надо запомнить на будущее, что ни золото, ни свинец – не самые тяжелые металлы в мире! Иридий и осмий – вот победители в весе!

Какой металл самый легкий?
В сознании многих людей металлы ассоциируются с чем-то тяжелым и твердым. Но в то же время есть металлические элементы, которые легче воды и не тонут в ней, а плавают на поверхности.
Это происходит из-за больших размеров атомов и как следствие малой плотности. Так какой же металл самый легкий? Достаточно взглянуть на периодическую систему Менделеева, чтобы понять, что это литий.
Он почти вдвое легче воды.
Основные свойства лития
Плотность лития составляет всего 0,543 грамма на сантиметр кубический. Металл входит в щелочную группу, которая характеризуется очень высокой химической активностью. Поэтому в природе литий образует сложные многоэлементные соединения, входящие в состав горных пород.
При этом литий является самым неактивным щелочным металлом, так что достаточно устойчиво проявляет себя после выделение в чистом виде. Физические свойства самого легкого металла на Земле выглядят следующим образом: в нормальных условиях серебристо-белый металл, мягкий (можно резать ножом), ковкий и пластичный.
Температура плавления — 181 градус по Цельсию. Атомная масса — 6,941 грамм на моль.

Химические свойства характерны для металлов щелочной группы. Но литий, в отличие от остальных щелочных элементов при комнатной температуре медленно реагирует с кислородом и другими веществами.
Зато при нагревании вступает в реакцию с газами, кислотами и основаниями. При нагревании до 300 градусов по Цельсию литий самовоспламеняется и горит красно-синим пламенем.
В отличие от остальных элементов щелочной группы покрывается устойчивой оксидной пленкой и перестает реагировать с кислородом.

Литий не хранят в керосине, так как из-за малой плотности он плавает на поверхности. Для его длительного хранения используют петролейный эфир, парафин, газолин или минеральное масло. В качестве емкости применяют жестяные банки с герметично закрывающимися крышками.
Литий является токсичным веществом и при попадании на открытые участки кожи вызывает зуд, раздражение и ожоги, поэтому при работе с ним необходимо использовать специальную защитную одежду.
Пары лития обжигают верхние дыхательные пути, так что нужно позаботиться и о защите органов дыхания.
Технология производства лития
Производство самого легкого металла в мире сводится к разложению его природных соединений. Это достаточно трудоемкая процедура ввиду большого количества составных элементов.
лития в добываемом сырье в среднем составляет 21 грамм на одну тонну. В промышленном производстве используют три метода разложения соединений лития: известковый, сульфатный и сернокислотный.
Первые два подразумевают спекание руды с оксидом/карбонатом кальция или сульфатом калия.

Протекает процедура при температуре 250-300 градусов. Затем полученную массу обрабатывают водой, получая карбонат или сульфат лития. После этого проводится процедура хлорирования с целью получения хлорида лития.
И, наконец, окончательную процедуру разделения проводят при помощи электролиза расплава в присутствии хлорида калия или бария, которые понижают температуру плавления литиевого хлорида.
Чистый металл оседает на катоде, откуда его можно собирать для дальнейшей переработки.
Сернокислотный способ подразумевает растворение руды в серной кислоте с образованием сульфата лития. Дальнейшая процедура протекает по указанной выше схеме.
Самый легкий металл применяется для производства эффективных полупроводников в сплавах с другими металлами, из него изготавливают аноды, используемые затем в процедурах электролиза, литий входит в состав ракетного топлива, в металлургии применяется в качестве сильного восстановителя менее активных металлов. В качестве различных соединений литий используется в производстве продукции для многих отраслей промышленности и народного хозяйства.
Алюминий
Если же брать самый крепкий и легкий металл, то им принято считать алюминий. Его плотность составляет 2,7 грамм на сантиметр кубический.
Этот металл достаточно распространен в природе и получил широкое применение в промышленности. Многие сплавы алюминия прочнее стали и при этом гораздо легче нее.
Уже сейчас использование алюминиевых конструкций в строительной сфере вышло на новый уровень.

К тому же этот элемент гораздо более стойко переносит воздействие коррозии и не требует для этого дополнительной закалки. Алюминий входит в состав авиационных сплавов, из которых изготавливают обшивку самолетов. Некоторые ученые предполагают, что в будущем его сплавы смогут полностью вытеснить сталь.
К тому же не прекращаются опыты по выделению новых элементов, сочетающих в себе положительные черты существующих веществ, но лишенные их природных недостатков. Так что возможно вскоре будет открыт новый самый легкий и прочный металл, который заявит о себе во всеуслышание.
Какой сплав считается самым прочным в мире
Металлы вместе с легирующими добавками образуют самый прочный сплав. В первую очередь, это касается твердости.
Кроме того, они отличаются рядом показателей, среди которых тепло и электропроводность. Прочные сплавы востребованы в промышленности.
Особенно это касается самолетостроения, где наряду с прочностью требуется легкость. В крепких сплавах нуждается автомобилестроение и судостроение.

О металлах в природе
Металлы разделяются на черные и цветные. Классическим представителем первого вида является железо. Цветные образуют более дорогостоящую группу.
Как производят металлы
Металлы в чистом виде в природе не встречаются. Содержатся они в рудах.
Их производство идет по следующим этапам:
- определение месторождений;
- добыча руды:
- извлечение металла.
Самые прочные из металлов
Прочность — это свойство металла противостоять внешним нагрузкам. Сопротивляемость элемента обеспечивается его внутренней структурой, способной создавать внутреннее напряжение, которое противостоит наружному давлению.
К самым прочным металлам относятся:
- титан;
- рений;
- бериллий;
- хром;
- тантал;
- иридий.
Самый прочный сплав
Самые твердые сплавы в мире — вольфрамовые. Основу составляют порошки, состоящие из нескольких карбидов металлов и кобальта. Смешивание ведется в определенной пропорции. Разработанная учеными технология позволяет получать сплавы высокой степени твердости.
Маркируются такие соединения буквенным обозначением: ВК3, где В —принадлежность к вольфрамовой группе. К — содержание кобальта в процентах.
Физические и химические свойства
Основные физические свойства вольфрамовых сплавов:
- Характерной особенностью является красностойкость. Она составляет 800 градусов. Термин означает, что режущая кромка в состоянии выдерживать такую температуру. Это обеспечивается высокой теплопроводностью. Благодаря чему идет отвод тепла.
- Высокая твердость, которая составляет 90 единицы по Роквеллу.
- Температура плавления достигает 2780 градусов.
Химическая стойкость к внешней среде повышается с увеличением процентного содержания кобальта.

Химические свойства титана
Особенности изготовления и сферы применения
Технология получения твердых сплавов из вольфрама состоит из следующих этапов:
- Сначала формируется грубый порошок вольфрама, который затем измельчается и просеивается.
- Таким же образом получаются порошки карбида вольфрама и кобальта.
- Идет их перемешивание с добавлением клея. В этом качестве выступает каучук, растворенный в бензине.
- Смесь подсушивается и прессуется.
- Технологический процесс заканчивается двумя спеканиями.
Твердый материал используется в изготовлении следующих изделий:
- резцов для токарных станков;
- клейм;
- валки для прокатки;
- шариков и обоймы для подшипников.
- напайки для инструмента горнодобывающего оборудования;
Любое производство нуждается в обработке изделий. Чтобы обеспечить этот процесс, необходим материал более высокой твердости. Эту функцию выполняют твердые сплавы.
4-4 Твердые сплавы и материалы Какой сплав считается самым прочным в мире Ссылка на основную публикацию 

Самый твердый металл в мире. Топ-10 металлов
Огромное количество металлов, которые существуют в мире, имеют каждый свои особенности и характеристики. Есть пластичные и ковкие металлы, есть с большими и маленькими коэффициентами сопротивления.
Но есть металлы, которые отличаются уникальными параметрами по твердости. Лидером среди твердых металлов в мире считается титан. Но и у него есть несколько соперников.
Физико-химические параметры титана
Полностью без примесей данный элемент первый раз выведен в Швеции в 1825 году. Это сделал химик с известной фамилией Берцелиус. Титан — это металл небольшого веса серебристо-белого оттенка. У него малая молекулярная масса. Она равна всего 22. Данный элемент отличается следующими характеристиками:
- Плотность — пока материал находится в твердом состоянии до достижения точки кипения 4,51 г/куб. см. В виде жидкости плотность имеет другое значение — 4.12 г/куб.см
- Параметры плавления — 1668°С.
- Параметры кипения — 3227°С.
- Упругость у титана небольшая, что считается его существенным недостатком.
- Твердость по шкале НВ имеет показатель 103. Он может меняться в зависимости от наличия примесей в веществе и достигать более высоких показателей.
- В стандартных условиях рассматриваемый металл практически не ржавеет, что является его неоспоримым преимуществом.
- По биологическим показателям это совсем инертный материал, поэтому активно используется в медицине. Инертность может уменьшаться при повышении температуры. Например, при +200°С металл успешно поглощает водород и изменяет все свои характеристики.
- Мало и тяжело проводит ток.
Если брать за образец шкалу МООСА, то по твердости титан имеет оценку 4.5. Это указывает на то, что это не самый твердый металл. Но из имеющихся твердых он используется чаще всего.

Применение титана
Данное вещество получило очень широкое применение практически во всех областях промышленности. На данный момент титан с успехом используется:
- Авиационная промышленность — многие детали самолета подвергаются воздействию высоких температур и сильных деформирующих сил. Именно поэтому части шасси, заклепки, различные силовые элементы корпуса делают из титана.
- Космическая техника. Также производят многие детали космических кораблей, особенно их обшивки.
- Кораблестроение.
- Нефтегазовая промышленность. Здесь титан используется для изготовления бурящих труб, насосов с высоким давлением.
- Строительство. Здесь твердый металл нужен для разных видов обшивки зданий, кровля, памятники.
- Медицина — многие видов протезов, а также инструменты.
- Спорт — инвентарь, детали для велосипедов, турники, спортивные принадлежности.
- Производство химических веществ. Материал просто не заменим в тех случаях, когда нужно прочное вещество, которое не будет реагировать с кислотами. Поэтому в химической промышленности из титана делают самые разные обменники, конструкции и трубы.

При всей своей твердости материал по весу отличается легкостью. Поэтому столь широко применение данного вещества во всех областях промышленности. Он в течение долгого времени не изнашивается, не деформируется.
Новости
Кольцеобразное затмение Солнца 26 декабря 2019 года
23 Декабря 2019 Полоса кольцеобразной фазы пройдет по восточной части Африки, Саудовской Аравии, Омана, южной Индии и некоторых районов Индонезии, по акватории Индийского и Тихого океанов. Максимальная продолжительность кольцеобразной фазы затмения составит 3 минуты 40 секунд секунды при фазе 0,97. На территории России кольцеобразная фаза затмения наблюдаться не будет.
Звездопад Геминиды 2019!
13 Декабря 2019 В ночь с 14 на 15 декабря ожидается красивый и мощный звездопад года из созвездия Близнецы! Прогнозируется до 120 метеоров в час, но полная Луна в этом году существенно помешает наблюдениям.
Радиогенные элементы — полоний и ра́дий
11 Декабря 2019 Химические элементы полоний и радий неотделимы от имён их первооткрывателей – супругов Кюри, которые потратили на их поиски годы непрерывного титанического труда.
Затмения Солнца
10 Декабря 2019 В конце декабря 2019 года произойдет кольцеобразное затмение Солнца. Какие бывают затмения? Почему и как они происходят?
Древнейший элемент – сера
4 Декабря 2019 Когда была открыта сера (символ S), не известно, но известно точно, что сера начала служить человеку задолго до того, как заняла в Таблице Менделеева клетку под №16. Месторождения самородной серы разрабатывались древними греками и римлянами.
Элементы: названный в честь Луны – селен
27 Ноября 2019 Селен был открыт в 1817 году (через 35 лет после теллура) авторитетнейшим химиком и минералогом своего времени Йёнсом Якобом Берцелиусом. Новый элемент оказался очень похожим на теллур, поэтому Берцелиус предложил назвать его Selenium с символом Se, от греческого σελήνη — Луна.
Астрономический прогноз на декабрь 2019
21 Ноября 2019 Астрономическая зима наступит 22 декабря 2019 года в 7:19 мск, в день зимнего солнцестояния, после которого каждый последующий день будет дарить нам немного больше света. К новому году продолжительность светового дня увеличится почти на 8 минут!
Источник https://vertical-opora.ru/metally-ih-svojstva-i-raznovidnosti
Источник https://90zavod.ru/raznoe/samyj-legkij-metall-iz-ispolzuemyx-v-promyshlennosti-samye-legkie-metally-v-mire.html
Источник https://cultura-yamala.ru/tvorchestvo/kakoj-samyj-legkij-metall-v-mire.html



