Содержание
Наиболее легкоплавкие металлы: свойства, особенности, физические характеристики
Плавление – процесс перехода из твердого состояния в жидкое. Он происходит под воздействием тепла, но зависит еще от ряда физических факторов, например от давления. Важную роль в том, насколько легко и тяжело вещество поддается плавлению, также играет его состав, размер кристаллов в решетке и прочность связей между атомами.
Температура плавления металлов очень разнится и может иметь даже минусовые значения. Она колеблется от -39 до +3410 градусов Цельсия. Тяжелее всего в жидкость превращаются молибден, вольфрам, хром, титан. Для этого процесса их требуется нагреть до температуры не менее 2000 градусов.
Наиболее легкоплавкими металлами являются галлий, ртуть, литий, олово, свинец, цинк, индий, висмут, таллий. Подробнее о некоторых из них читайте далее.

Температура плавления металлов
Большая часть элементов периодической таблицы относится к металлам. В настоящее время их насчитывается примерно 96. Всем им необходимы разные условия, чтобы превратиться в жидкость.
Порог нагревания твердых кристаллических веществ, превысив который они становятся жидкими, называется температурой плавления. У металлов она колеблется в пределах нескольких тысяч градусов. Многие из них переходят в жидкость при относительно большом нагревании. Благодаря этому они являются распространенным материалом для производства кастрюль, сковородок и других кухонных приборов.
Средние температуры плавления имеют серебро (962 °С), алюминий (660,32 °С), золото (1064,18 °С), никель (1455 °С), платина (1772 °С) и т.д. Выделяют также группу тугоплавких и легкоплавких металлов. Первым, чтобы превратиться в жидкость, нужно больше 2000 градусов Цельсия, вторым – меньше 500 градусов.
К легкоплавким металлам обычно относят олово (232 °C), цинк (419 °C), свинец (327 °C). Однако у некоторых из них температуры могут быть еще ниже. Например, франций и галлий плавятся уже в руке, а цезий можно греть только в ампуле, ведь от кислорода он воспламеняется.

Самые низкие и высокие температуры плавления металлов представлены в таблице:
| Тугоплавкие | Легкоплавкие | ||
| Вольфрам | 3422 °C | Ртуть | -38,87 °C |
| Рений | 3186 °C | Галлий | 26,79 °C |
| Тантал | 3017 °C | Франций | 27 °C |
| Осмий | 3033 °C | Цезий | 28,5 °C |
| Молибден | 2623 °C | Рубидий | 39,31 °C |
| Ниобий | 2477 °C | Калий | 63,5 °C |
| Иридий | 2466 °C | Натрий | 97,8 °C |
Ртуть
Полезный во многих сферах, но ядовитый металл был известен еще до нашей эры. Ртуть использовали античные и средневековые медики для лечения венерических и многих других заболеваний, алхимики пытались сделать из нее золото. Сегодня она применяется в электротехнике, приборостроении и органической химии.
Руть – это наиболее легкоплавкий металл на планете. При нормальных комнатных условиях она всегда жидкая, так как температура ее плавления составляет -39 градуса. Ее пары очень опасны, поэтому ртуть содержат только в контейнерах и специальных стеклянных колбах. На организм она действует как яд, отравляя его и выводя из строя нервную, иммунную, дыхательную и пищеварительную системы.
Галлий
Вторым в списке наиболее легкоплавких металлов находится галлий. Он становится жидкостью при температуре выше 29,5 градусов Цельсия, и размягчить его можно просто подержав немного в руках. При нормальных условиях галлий очень хрупкий, легко поддается механическому воздействию и окрашен в светло-серебристый, несколько голубоватый оттенок.
Металл очень рассеян в земной коре и не встречается в виде самородков. В природе его находят в составе различных минералов, таких как гранат, мусковит, турмалин, хлорит, полевой шпат. Кроме того, он содержится в морской воде. Галлий используют в высокочастотной электронике, для изготовления зеркал и различных сплавов.

Легкоплавкие металлы и их сплавы
Цинк имеет кристаллическую ГП-решетку с параметрами а =
0,2664 нм и
с
= 0,4945 нм, его плотность составляет 7,13 г/см3. Марки первичного цинка по ГОСТ 3640-94 приведены в табл. 9.1. Содержание этого металла в земной коре составляет 0,005 %. Он широко используется в промышленности в различных формах: в чистом виде как основа цинковых сплавов и в качестве легирующей добавки (например, в алюминиевые и медные сплавы).
Таблица 9.1.
Марки и химический состав первичного цинка (ГОСТ 3640-94)
Марка
| Zn, %, не менее | Примеси, %, не более | ||||||||
| РЬ | Cd | Fe | Си | Sn | As | Al | Всего | ||
| ЦВОО | 99,997 | 0,00001 | 0,002 | 0,00001 | 0,00001 | 0,00001 | 0,0005 | 0,00001 | 0,003 |
| цво | 99,995 | 0,003 | 0,002 | 0,002 | 0,001 | 0,001 | 0,0005 | 0,005 | 0,005 |
| цв | 99,99 | 0,005 | 0,002 | 0,003 | 0,001 | 0,001 | 0,0005 | 0,005 | 0,01 |
| ЦОА | 99,98 | 0,01 | 0,003 | 0,003 | 0,001 | 0,001 | 0,0005 | 0,005 | 0,02 |
| ЦО | 99,975 | 0,013 | 0,004 | 0,005 | 0,001 | 0,001 | 0,0005 | 0,005 | 0,025 |
| ш | 99,95 | 0,02 | 0,01 | 0,01 | 0,002 | 0,001 | 0,0005 | 0,005 | 0,05 |
| Ц2 | 98,7 | 1,0 | 0,2 | 0,05 | 0,005 | 0,002 | 0.01 | 0,010 | 1,3 |
| цз | 97,5 | 2,0 | 0,2 | 0,1 | 0,05 | 0,005 | 0,01 | — | 2,5 |
Как видно из данных табл. 9.1, самая чистая марка цинка (ЦВОО) содержит
Промышленные цинковые сплавы подразделяют на литейные и антифрикционные, они разработаны на основе системы Zn-Al-Cu. Составы стандартных литейных цинковых сплавов приведены в табл. 9.2, а антифрикционных по ГОСТ 21437-95 -в табл. 9.3.
Таблица 9.2.
Марки и химический состав некоторых литейных сплавов на основе цинка (ГОСТ 25140-93)
- 0,7-
- 1,3
- 7,1-
- 8,9
- 0,70-
- 1,40
- 28,5-
- 32,1
- 3,8-
- 5,6
- 0,01-
- 0,5
Таблица 9.3.
Марки и химический состав антифрикционных сплавов на основе цинка (ГОСТ 21437-95)
- 9,0-
- 11,0
- 1.0-
- 2,0
- 9,0-
- 12.0
- 4,0-
- 5,5
Сплав ЦА4, как следует из диаграммы состояния Zn-Al (рис. 9.1), является практически чисто эвтектическим (с небольшим количеством первичных кристаллов цинкового твердого
Рис. 9.1. Фазовая диаграмма системы Zn-Al
раствора), что обеспечивает его высокие литейные характеристики при удовлетворительных механических свойствах. Алюминиевый твердый раствор при охлаждении ниже 275 °С претерпевает монотектоидный распад (А1)’—>(А1)» + (Zn), что видно на фазовой диаграмме Al-Zn (см. рис. 9.1). Это может привести к изменению размеров деталей. Малая добавка магния (до 0,1 %) позволяет подавить этот распад и, следовательно, повысить размерную стабильность. Кроме того, магний повышает коррозионную стойкость, поэтому почти все цинковые сплавы содержат этот элемент в качестве добавки (см. табл. 9.2, 9.3). Однако при больших концентрациях магний становится нежелательным, поскольку он практически не растворяется в цинке и образует хрупкие включения фазы MgZn2. Особенностью двойной диаграммы Zn-Al является то, что предельное содержание цинка в алюминиевом твердом растворе превышает 80 %, поэтому многие цинковые сплавы имеют в качестве основной фазы А1, а не Zn.
Цинковые сплавы с добавкой меди согласно фазовой диаграмме Al-Zn-Cu (рис. 9.2) содержат (кроме алюминиевого и цинкового твердых растворов) фазу CuZn3 (в), которая может кристаллизоваться первично (при содержании меди ближе к верх нему пределу), а также по моновариантным (L (Al) + CuZn3 и L (Zn) + CuZn3) и нонвариантной (L (А1) + (Zn) + CuZn3) эвтектическим реакциям. Литейные цинковые сплавы с медью в зависимости от состава различаются по структурным составляющим, что отражено в табл. 9.4; видно, что в большинстве сплавов присутствует тройная эвтектика, которая определяет их солидус (377 °С). В структуре эту эвтектику можно отличить от двойной по более дисперсному строению (рис. 9.3).
Таблица 9.4.
Структурные составляющие в промышленных цинковых сплавах
| Марка сплава | Первичные кристаллы | Двойная эвтектика | Тройная эвтектика’ |
| ЦА4 | Zn | Al + Zn | — |
| ЦА4М1 | Zn | Al + Zn | + |
| ЦА4МЗ | — | Zn + CuZn3 | + |
| ЦА8М1 | Al | Al + Zn | + |
| ЦА30М5 | Al | Al + CuZn3 | — |
| ЦАМ 9-1,5 | Al | Al + Zn | + |
| ЦАМ10-5 | Al | Al + CuZn3 | + |
Временное сопротивление разрыву большинства литейных цинковых сплавов не превышает 300 МПа, а в целом их механические свойства (табл. 9.5) находятся примерно на уровне силуминов, поэтому у них имеются совпадающие области применения (в частности, тонкостенные корпусные детали, получаемые литьем под давлением). Самым прочным цинковым литейным сплавом является наиболее легированный среди них — ЦА30М5. Хотя следует заметить, что в нем алюминиевый твердый раствор содержит меньше цинка, чем, например, ЦА8М1 (в первом приближении это можно оценить и по двойной фазовой диаграмме Al-Zn; см. рис. 9.1). Механические свойства антифрикционных сплавов (табл. 9.6) примерно такие же, как и у литейных (см. табл. 9.5).
Литейные цинковые сплавы используют в автомобильной, тракторной, электротехнической и других отраслях промышленности для отливки деталей приборов, в том числе таких, от

Рис. 9.2. Фазовая диаграмма системы Zn-Al-Cu

Рис. 9.3. Микроструктура цинкового сплава ЦАМ 10-5 (структурные составляющие см. в табл. 9.4)
которых требуется высокая стабильность и точность размеров (ЦА4, ЦА4МЗ). Из них также отливают вкладыши подшипников, втулки балансированной подвески, червячные шестерни, сепараторы подшипников качения (ЦА30М5).
Таблица 9.5.
Механические свойства некоторых литейных сплавов на основе цинка
- * Д-литье под давлением.
- * К-литье в кокиль.
Таблица 9.6.
Механические свойства цинковых антифрикционных сплавов
| Марка сплава | Механические свойства | ||
| Временное сопротивление разрыву, МПа | Относительное удлинение, % | Твердость, НВ | |
| Литейные сплавы | |||
| ЦАМ 9-1,5Л | 245 | 1,0 | 95 |
| ЦАМ 10-5Л | 245 | 0,4 | 100 |
| Сплавы, обрабатываемые давлением | |||
| ЦАМ 9-1,5 | 294 | 10,0 | 85 |
| ЦАМ 10-5 | 343 | 4,0 | 90 |
Антифрикционный сплав ЦАМ 9-1,5Л используют для производства монометаллических вкладышей, втулок, ползунов, а также для получения биметаллических изделий с металлическим каркасом литья. Сплав ЦАМ 9-1,5 применяют для получения биметаллической ленты из стали и дуралюмина методом прокатки с последующей штамповкой вкладышей.
Сплав ЦАМ 10-5Л рекомендуется для отливки подшипников и втулок различных агрегатов, а из сплава ЦАМ 10-5 получают прокатанные полосы для направляющих скольжения металлорежущих станков и других изделий. Предельные рабочие температуры антифрикционных сплавов не превышают 80-100 °С, а удельное давление — 100-250 МПа (в зависимости от скорости скольжения).
Индий
В качестве простого вещества индий очень светлый, ковкий и мягкий настолько, что даже оставляет след, если им провести по бумаге. Он также является одним из наиболее легкоплавких металлов, но воздействуют на него только температуры выше 157 °C. Закипает он при 2072 градусах.
Как и галлий, индий не образует собственных месторождений, но содержится в различных рудах. Благодаря своей рассеяности в природе металл довольно дорогой. Его применяют в микроэлектронике, для изготовления легкоплавких сплавов, припоев, жидкокристаллических экранов для техники.

Виды и составы легкоплавких сплавов
Легкоплавкие сплавы применяемые в современной мировой промышленности:
Примечание: Несколько различных Tпл для одного и того же сплава — результат разночтений источников данных
- Т — теплоноситель
- П — припой
- М — модельный литейный сплав
- Ж — для датчиков пожарной сигнализации
- Л — лабораторный для абсолютирования растворителей
- И — рабочее тело ионных ракетных двигателей
Олово
Олово плавится от температуры выше 231 градуса по Цельсию. Это пластичный и мягкий металл, светло-серебристого цвета. Оно существует четырех аллотропных модификациях, две из них появляются только при высоком давлении.
Олово довольно рассеяно в природе, но может образовывать собственные минералы, например, станнин и касситерит. Его используют в качестве покрытия для металлов для усиления их устойчивости к коррозии, а также для производства жести, фольги, разнообразных сплавов, посуды и деталей для музыкальных инструментов.
Области применения легкоплавких сплавов
Во всех областях применения легкоплавких сплавов главным востребованным свойством является заданная низкая температура плавления. Это свойство, в частности, используется для пайки микросхем, которые могут выйти из строя из-за перегрева при пайке обычными припоями. Кроме того, эти сплавы должны иметь определённую плотность, прочность на разрыв, химическая инертность, вакуумоплотность, теплопроводность. В настоящий момент основными областями применения легкоплавких сплавов являются:
- Производство и применение жидкометаллических теплоносителей в энергетике и машиностроении.
- Литейное дело (производство выплавляемых моделей).
- Системы раннего оповещения возгораний (датчики температуры, клапаны пожаротушения и др).
- Термометрия (рабочее тело для термометров различных типов).
- Вакуумная техника (уплотнения, паяные швы и др.).
- Микроэлектроника (припои, покрытия, датчики температуры, предохранители и др.)
- Медицина (фиксация костей, протезирование и др.)
- Использование в качестве расплавляемой металлической смазки.
Литий
Литий – наиболее легкоплавкий металл, который становится жидкостью при температуре 180 градусов. Он мягкий, хорошо поддается ковке и механической обработке. Он относится к щелочным металлам, но проявляет активность гораздо хуже остальных представителей группы. Он медленно реагирует с влажным воздухом, а в сухой атмосфере остается практически стабильным

Металл встречается в сподумене, лепидолите, в месторождениях с оловом, висмутом и вольфрамом, содержится в морской воде и в звездных космических объектах. Литий часто используется для изготовления гальванических элементов, аккумуляторов, применяют в качестве окислителя, а также в пиротехнике. В сплавах с кадмием, медью и алюминием используется в космической, военной и авиационной технике.
Щелочные металлы
Щелочные металлы
Щелочные металлы — элементы главной подгруппы I группы Периодической системы химических элементов Д. И. Менделеева:
литий Li, натрий Na, калий K, рубидий Rb, цезий Cs и франций Fr.
Данные металлы получили название щелочных, потому что большинство их соединений растворимо в воде. По-славянски «выщелачивать» означает «растворять», это и определило название данной группы металлов. При растворении щелочных металлов в воде образуются растворимые гидроксиды, называемые щёлочами.
Основная характеристика щелочных металлов:
В Периодической системе они следуют сразу за инертными газами, поэтому особенность строения атомов щелочных металлов заключается в том, что они содержат один электрон на новом энергетическом уровне: их электронная конфигурация ns1.
Валентные электроны щелочных металлов могут быть легко удалены, потому что атому энергетически выгодно отдать электрон и приобрести конфигурацию инертного газа.
Поэтому для всех щелочных металлов характерны восстановительные свойства. Это подтверждают низкие значения их потенциалов ионизации (потенциал ионизации атома цезия — один из самых низких) и электроотрицательности (ЭО). Далее таблица свойств щелочных металлов:
Свойства щелочных металлов
| Атомный номер | Название, символ | Металлический радиус, нм | Ионный радиус, нм | Потенциал ионизации, эВ | ЭО | p, г/см³ | tпл, °C | tкип, °C |
| 3 | Литий Li | 0,152 | 0,078 | 5,32 | 0,98 | 0,53 | 181 | 1347 |
| 11 | Натрий Na | 0,190 | 0,098 | 5,14 | 0,93 | 0,97 | 98 | 883 |
| 19 | Калий K | 0,227 | 0,133 | 4,34 | 0,82 | 0,86 | 64 | 774 |
| 37 | Рубидий Rb | 0,248 | 0,149 | 4,18 | 0,82 | 1,53 | 39 | 688 |
| 55 | Цезий Cs | 0,265 | 0,165 | 3,89 | 0,79 | 1,87 | 28 | 678 |
Все металлы этой подгруппы имеют серебристо-белый цвет
(кроме серебристо-жёлтого цезия), они очень мягкие, их можно резать скальпелем. Литий, натрий и калий легче воды и плавают на её поверхности, реагируя с ней.
Щелочные металлы встречаются в природе в форме соединений, содержащих однозарядные катионы.
Многие минералы содержат в своём составе металлы главной подгруппы I группы. Например, ортоклаз, или полевой шпат, состоит из алюмюсиликата калия K2[Al2Si6O16], аналогичный минерал, содержащий натрий — альбит — имеет состав Na2[Al2Si6O16]. В морской воде содержится хлорид натрия NaCl, а в почве — соли калия — сильвин KCl, сильвинит NaCl • KCl, карналлит KCl • MgCl2 • 6H2O, полигалит K2SO4 • MgSO4 • CaSO4 • 2H2O. Химические свойства щелочных металлов Из-за высокой химической активности щелочных металлов по отношению к воде, кислороду, азоту их хранят под слоем керосина. Чтобы провести реакцию со щелочным металлом, кусочек нужного размера аккуратно отрезают скальпелем под слоем керосина, в атмосфере аргона тщательно очищают поверхность металла от продуктов его взаимодействия с воздухом и только потом помещают образец в реакционный сосуд.
1. Взаимодействие с водой. Важное свойство щелочных металлов
— их высокая активность по отношению к воде. Наиболее спокойно (без взрыва) реагирует с водой литий: При проведении аналогичной реакции натрий горит жёлтым пламенем и происходит небольшой взрыв. Калий ещё более активен: в этом случае взрыв гораздо сильнее, а пламя окрашено в фиолетовый цвет. 2. Взаимодействие с кислородом. Продукты горения щелочных металлов на воздухе имеют разный состав в зависимости от активности металла.
Только литий сгорает на воздухе с образованием оксида стехиометрического состава: При горении натрия в основном образуется пероксид Na2O2 с небольшой примесью надпероксида NaO2: В продуктах горения калия, рубидия и цезия содержатся в основном надпероксиды: Для получения оксидов натрия и калия нагревают смеси гидроксида, пероксида или надпероксида с избытком металла в отсутствие кислорода: Для кислородных соединений щелочных металлов характерна следующая закономерность: по мере увеличения радиуса катиона щелочного металла возрастает устойчивость кислородных соединений, содержащих пероксид-ион О22-и надпероксид-ион O2-.
Для тяжёлых щелочных металлов характерно образование довольно устойчивых озонидов состава ЭО3. Все кислородные соединения имеют различную окраску, интенсивность которой углубляется в ряду от Li до Cs:
| Формула кислородного соединения | Цвет |
| Li2O | Белый |
| Na2O | Белый |
| K2O | Желтоватый |
| Rb2O | Жёлтый |
| Cs2O | Оранжевый |
| Na2O2 | Светло- жёлтый |
| KO2 | Оранжевый |
| RbO2 | Тёмно- коричневый |
| CsO2 | Жёлтый |
Оксиды щелочных металлов обладают всеми свойствами, присущими основным оксидам: они реагируют с водой, кислотными оксидами и кислотами: Пероксиды и надпероксиды проявляют свойства сильных окислителей: Пероксиды и надпероксиды интенсивно взаимодействуют с водой, образуя гидроксиды: 3. Взаимодействие с другими веществами. Щелочные металлы реагируют со многими неметаллами. При нагревании они соединяются с водородом с образованием гидридов, с галогенами, серой, азотом, фосфором, углеродом и кремнием с образованием, соответственно, галогенидов, сульфидов, нитридов, фосфидов, карбидов и силицидов: При нагревании щелочные металлы способны реагировать с другими металлами, образуя интерметаллиды. Активно (со взрывом) реагируют щелочные металлы с кислотами.
Щелочные металлы растворяются в жидком аммиаке и его производных — аминах и амидах: При растворении в жидком аммиаке щелочной металл теряет электрон, который сольватируется молекулами аммиака и придаёт раствору голубой цвет. Образующиеся амиды легко разлагаются водой с образованием щёлочи и аммиака: Щелочные металлы взаимодействуют с органическими веществами спиртами (с образованием алкоголятов) и карбоновыми кислотами (с образованием солей): 4. Качественное определение щелочных металлов. Поскольку потенциалы ионизации щелочных металлов невелики, то при нагревании металла или его соединений в пламени атом ионизируется, окрашивая пламя в определённый цвет:
Окраска пламени щелочными металлами
| Li | Карминно-красный |
| Na | Жёлтый |
| K | Фиолетовый |
| Rb | Беловато-розовый |
| Cs | Фиолетово-красный |
Получение щелочных металлов 1. Для получения щелочных металлов используют в основном электролиз расплавов их галогенидов, чаще всего — хлоридов, образующих природные минералы: катод: Li+ + e → Li анод: 2Cl- — 2e → Cl2 2. Иногда для получения щелочных металлов проводят электролиз расплавов их гидроксидов: катод: Na+ + e → Na анод: 4OH- — 4e → 2H2O + O2 Поскольку щелочные металлы в электрохимическом ряду напряжений находятся левее водорода, то электролитическое получение их из растворов солей невозможно; в этом случае образуются соответствующие щёлочи и водород. Соединения щелочных металлов. Гидроксиды
Для получения гидроксидов щелочных металлов в основном используют электролитические методы. Наиболее крупнотоннажным является производство гидроксида натрия электролизом концентрированного водного раствора поваренной соли:
Какой самый легкий металл
Какой металл самый легкий? Его свойства и особенности
Слово «металл» часто ассоциируется с тяжеловесностью. Это далеко не так. Все металлы обладают очень разными свойствами. Некоторые из них настолько лёгкие, что даже не тонут в воде. Какой металл самый легкий? Какие у него свойства? Давайте узнаем.
Самые легкие металлы в мире
Лёгкими называют металлы, которые обладают небольшой плотностью. Это отнюдь не редкое явление. Вещества с такими характеристиками составляют примерно 20 % от массы земной коры. Они активно добываются и широко применяются в промышленности.
Самым лёгким металлом является литий. Кроме наименьшей атомной массы, он обладает и наименьшей плотностью, которая в два раза ниже, чем у воды. После лития идут калий, натрий, алюминий, рубидий, цезий, стронций и т. д. В их число входит и титан, который обладает самой высокой прочностью среди металлов.
Легкостью и прочностью обладает также алюминий. В земной коре он третий по распространённости. Пока люди не научились получать его промышленным путём, металл был дороже золота. Сейчас килограмм алюминия можно купить примерно за 2 доллара. Его применяют как в ракетной технике и военной промышленности, так и для изготовления пищевой фольги и кухонных предметов.

Литий
Литий находится в первой группе периодической таблицы элементов. Он стоит под номером 3, после водорода и гелия, и обладает самой маленькой атомной массой среди всех металлов. Простое вещество – литий, при нормальных условиях имеет серебристо-белый цвет.
Это самый лёгкий щелочной металл с плотностью 0,534 г/см³. Из-за этого он всплывает не только в воде, но и в керосине. Для его хранения обычно используют парафин, газолин, минеральные масла или петролейный эфир. Литий очень мягкий и пластичный, легко режется ножом. Чтобы расплавить этот металл, его нужно нагреть до температуры 180,54 °C. Закипит он только при 1340 °C.
В природе существует только два стабильных изотопа металла: Литий-6 и Литий-7. Кроме них, есть 7 искусственных изотопа и 2 ядерных изомера. Литий является промежуточным продуктом в реакции превращения водорода в гелий, участвуя, таким образом, в процессе образования звёздной энергии.

Реакции с литием
Учитывая его щелочную природу, можно предположить, что он очень активен. Однако металл является самым спокойным представителем своей группы. При нормальной комнатной температуре литий слабо реагирует с кислородом и многими другими веществами. Свой «бурный нрав» он проявляет после нагревания, тогда он вступает в реакцию с кислотами, различными газами и основаниями.
В отличие от других щелочных металлов с водой он реагирует мягко, образуя гидроксид и водород. С сухим воздухом реакции практически нет. Но если он влажный, то литий медленно реагирует с его газами, образуя нитрид, карбонат и гидроксид.
При определённых температурах самый легкий металл активен с аммиаком, этиловым спиртом, галогенами, водородом, углеродом, кремнием, серой.

Сплавы лития
Свойства лития повышают отдельные качества металлов, из-за чего его часто используют в сплавах. Полезной является его реакция с окислами, водородом, сульфидами. При нагревании он образует с ними нерастворимые соединения, которые легко извлечь из расплавленных металлов, очистив их от этих веществ.
Для придания сплаву стойкости к коррозии и пластичности его смешивают с магнием и алюминием. Медь в сплаве с ним становится более плотной и менее пористой, лучше проводит электричество. Самый легкий металл повышает твёрдость и пластичность свинца. При этом он повышает температуру плавления многих веществ.
Благодаря литию металл становится прочным и устойчивым к разрушениям. При этом он не утяжеляет их. Именно поэтому сплавы на его основе применяются в космической инженерии и авиации. Главным образом используются смеси с кадмием, медью, скандием и магнием.
Нахождение в природе и значение
Самый легкий металл имеет около 30 собственных минералов, но только 5 из них используются в промышленности: пенталит, амблигонит, лепидолит, циннвальдит и сподумен. Кроме того, находится он в солёных озёрах. Всего в земной коре содержится 0,005 % этого металла.

Большие промышленные запасы лития находятся на всех континентах. Его добывают в Бразилии, Австралии, ЮАР, Канаде, США и других странах. После чего применяют его в электронике, металлургии, лазерных материалах, ядерной энергетике и даже медицине.
Большое содержание лития есть в гумусах, что говорит о его участии в круговороте природных веществ. Металл присутствует в организме животных, а также во многих растениях. Литием богаты персики, грибы, редис, картофель, морковь.
В нашем организме он содержится в печени, крови, лёгких, костях и других органов. Недостаток лития приводит к нарушениям в работе нервной системы и мозга. Он повышает устойчивость организма к болезням, активизирует деятельность ферментов. С помощью него борются с болезнью Альцгеймера, психическими расстройствами, склерозом, а также различными зависимостями.
Токсичность
Несмотря на важную биологическую роль лития в нашем организме, он может быть опасным. Самый легкий металл достаточно токсичен и способен вызывать отравления. При горении он провоцирует раздражение и отёки слизистых оболочек. Если на них попадет кусочек целого металла, произойдёт то же самое.

Литий нельзя брать в руки без перчаток. Взаимодействуя с влагой в воздухе или влагой на коже, он легко вызывает ожог. С расплавленным металлом нужно быть ещё осторожнее, так как его активность повышается в разы. При работе с ним нужно помнить, что это щелочь. Уменьшить его действие на кожу можно обычным уксусом.
В организме литий повышает устойчивость иммунной системы и улучшает работу нервной системы. Но его переизбыток сопровождается головокружением, сонливостью, потерей аппетита. Отравление металлом приводит к снижению либидо, слабости в мышцах, набору веса. При этом может ухудшиться зрение, память и наступить кома. Работать с литием нужно всегда в перчатках, защитном костюме и очках.
Какой металл самый легкий?
В сознании многих людей металлы ассоциируются с чем-то тяжелым и твердым. Но в то же время есть металлические элементы, которые легче воды и не тонут в ней, а плавают на поверхности. Это происходит из-за больших размеров атомов и как следствие малой плотности. Так какой же металл самый легкий? Достаточно взглянуть на периодическую систему Менделеева, чтобы понять, что это литий. Он почти вдвое легче воды.
Основные свойства лития
Плотность лития составляет всего 0,543 грамма на сантиметр кубический. Металл входит в щелочную группу, которая характеризуется очень высокой химической активностью. Поэтому в природе литий образует сложные многоэлементные соединения, входящие в состав горных пород. При этом литий является самым неактивным щелочным металлом, так что достаточно устойчиво проявляет себя после выделение в чистом виде. Физические свойства самого легкого металла на Земле выглядят следующим образом: в нормальных условиях серебристо-белый металл, мягкий (можно резать ножом), ковкий и пластичный. Температура плавления – 181 градус по Цельсию. Атомная масса – 6,941 грамм на моль.

Химические свойства характерны для металлов щелочной группы. Но литий, в отличие от остальных щелочных элементов при комнатной температуре медленно реагирует с кислородом и другими веществами. Зато при нагревании вступает в реакцию с газами, кислотами и основаниями. При нагревании до 300 градусов по Цельсию литий самовоспламеняется и горит красно-синим пламенем. В отличие от остальных элементов щелочной группы покрывается устойчивой оксидной пленкой и перестает реагировать с кислородом.

Литий не хранят в керосине, так как из-за малой плотности он плавает на поверхности. Для его длительного хранения используют петролейный эфир, парафин, газолин или минеральное масло. В качестве емкости применяют жестяные банки с герметично закрывающимися крышками. Литий является токсичным веществом и при попадании на открытые участки кожи вызывает зуд, раздражение и ожоги, поэтому при работе с ним необходимо использовать специальную защитную одежду. Пары лития обжигают верхние дыхательные пути, так что нужно позаботиться и о защите органов дыхания.
Технология производства лития
Производство самого легкого металла в мире сводится к разложению его природных соединений. Это достаточно трудоемкая процедура ввиду большого количества составных элементов. Содержание лития в добываемом сырье в среднем составляет 21 грамм на одну тонну. В промышленном производстве используют три метода разложения соединений лития: известковый, сульфатный и сернокислотный. Первые два подразумевают спекание руды с оксидом/карбонатом кальция или сульфатом калия.

Протекает процедура при температуре 250-300 градусов. Затем полученную массу обрабатывают водой, получая карбонат или сульфат лития. После этого проводится процедура хлорирования с целью получения хлорида лития. И, наконец, окончательную процедуру разделения проводят при помощи электролиза расплава в присутствии хлорида калия или бария, которые понижают температуру плавления литиевого хлорида. Чистый металл оседает на катоде, откуда его можно собирать для дальнейшей переработки.
Сернокислотный способ подразумевает растворение руды в серной кислоте с образованием сульфата лития. Дальнейшая процедура протекает по указанной выше схеме. Самый легкий металл применяется для производства эффективных полупроводников в сплавах с другими металлами, из него изготавливают аноды, используемые затем в процедурах электролиза, литий входит в состав ракетного топлива, в металлургии применяется в качестве сильного восстановителя менее активных металлов. В качестве различных соединений литий используется в производстве продукции для многих отраслей промышленности и народного хозяйства.
Алюминий
Если же брать самый крепкий и легкий металл, то им принято считать алюминий. Его плотность составляет 2,7 грамм на сантиметр кубический. Этот металл достаточно распространен в природе и получил широкое применение в промышленности. Многие сплавы алюминия прочнее стали и при этом гораздо легче нее. Уже сейчас использование алюминиевых конструкций в строительной сфере вышло на новый уровень.

К тому же этот элемент гораздо более стойко переносит воздействие коррозии и не требует для этого дополнительной закалки. Алюминий входит в состав авиационных сплавов, из которых изготавливают обшивку самолетов. Некоторые ученые предполагают, что в будущем его сплавы смогут полностью вытеснить сталь.
К тому же не прекращаются опыты по выделению новых элементов, сочетающих в себе положительные черты существующих веществ, но лишенные их природных недостатков. Так что возможно вскоре будет открыт новый самый легкий и прочный металл, который заявит о себе во всеуслышание.
Самый легкий металл
Когда мы говорим «металл», в нашем воображении представляется материал, который имеет высокую твердость и немалый вес. Но в мире есть такие металлы, плотность которых небольшая, а по этой причине они не тонут в воде. Давайте же узнаем, какой металл самый легкий. Именно таким считается литий (в два раза легче воды).
Характеристики лития

Самый легкий металл в мире обладает плотностью, равной 0,542 г/см3. Он является представителем металлов из щелочной группы, обладающих высочайшей химической активностью. По сути, в природе этот материал представляет собой сложнейшие соединения, состоящие из множества элементов. При нормальных условиях этот самый легкий металл, имеющий серебристо-белый цвет, является очень пластичным и пригодным для ковки. Плавление лития осуществляется при 181-ом градусе.
Данному металлу присущи характеристики, отличающие материалы щелочной группы. Однако он имеет свою особенность – под воздействием комнатной температуры в реакцию с кислородом или иными веществами вступает плохо. Однако стоит его нагреть, как он достаточно легко взаимодействует с кислотами и газами. Если нагреть самый легковесный металл до трехсот градусов, то он будет самовоспламеняться, а пламя будет иметь красно-синий цвет.

Легкий материал, помещенный в керосин, находится на поверхности жидкости ввиду своей малой плотности. Поэтому хранить его в такой жидкости не следует, а для этих целей лучше пользоваться минеральным маслом, парафином, петролейным эфиром. Емкостями для хранения лития выступают банки из жести, которые выполнены с герметично закрывающимися крышками. При работе с литием важно применять индивидуальные средства защиты и следовать инструкциям по технике безопасности, поскольку этот металл является токсичным. Пары лития спокойно могут обжечь органы дыхания, поэтому необходимо заботиться и о средствах защиты органов дыхания.
Где применяют литий?
Широко этот металл используется в сплавах. Например, когда идет процесс легирования алюминия, добавляет литий, что позволяет снизить плотность и улучшить степень упругости сплава. При изготовлении щелочных аккумуляторов применяют гидроксид лития. Наверняка, многим из вас знаком такой термин, как «литий-ионная батарея».

Керамика на основе силиката и алюмината лития используется в металлургической промышленности и для изготовления военной техники. Солями лития в медицинской сфере благополучно лечат заболевания, связанные с психическими расстройствами, так как карбонат лития обладает способностью стабилизировать человеческое настроение.
Текстильная, фармацевтическая и пищевая промышленности применяют для изготовления определенных товаров соединения лития. В сочетании с окислителями металл применяют для производства топлива для ракет. Нитрат лития просто необходим для создания пиротехнических средств. Оптическая отрасль пользуется фторидом лития. Из данного металла даже производят стекло, которое имеет определенный сорт.
Как производится литий?

При изготовлении этого материала осуществляется такой процесс, при котором раскладываются природные соединения лития. Из-за немалого числа входящих в состав компонентов данная процедура является довольно трудоемкой. В результате на 1000 килограммов получаемого путем добычи сырья приходится только двадцать один грамм лития.
Чтобы разложить соединения лития, пользуются тремя способами – сульфатным, известковым, сернокислотным. Первый и второй осуществляют способом спекания руды с оксидом кальция либо сульфатом калия. При этом все происходит при температуре от 250 до 300 градусов. После обработки получившейся массы водой осуществляется процесс хлорирования. В завершении проводится электролиз массы при использовании хлорида калия либо бария. Осевший на катодах литий забирается оттуда для последующей переработки.
Третий метод заключается в растворении полученного сырья в серной кислоте. Затем все осуществляется точно так же, как было описано выше. После получения чистого лития он отправляется в различные отрасли промышленности для изготовления необходимых изделий.
Передовые технологии: что еще легче лития?

Наука не стоит на одном месте, даря промышленности все более уникальные технологии. Так ученые получили металл, который гораздо легче по весу, чем литий. Такой металл получил название «микролаттис». Благодаря его невероятной легкости можно положить его на одуванчик, а растение при этом не деформируется.
Несмотря на свою легкость, микролаттис может выдерживать огромные нагрузки, а также восстанавливать первоначальную форму при нанесении ударов. Также материал легче полистирола в сто раз. При этом прочность его на высоте. Благодаря таким характеристикам металл используется в различных сферах – автопромышленность, аэрокосмическая промышленность, производство электродов для батарей и т.д.
Какой самый легкий металл

В группу легких металлов включаются металлы с плотностью ρ до 4,5 г/см3. Легкими металлами, важнейшими для технического применения (преимущественно как основа сплава), являются Al, Mg, Ti и Be. Если даже Al-сплавы по распространению представляют наиболее значительную группу среди легких металлов, то все же для специфических целей применения предлагают материалы Ti и Be, комплексы свойств которых заслуживают внимания для будущих разработок материалов. Магниевые сплавы уже очень давно нашли техническое применение, например, в строительстве дирижаблей и самолетов, но из-за их проблематичной обрабатываемости и их воспламеняемости были вытеснены. Очень незначительная плотность (ρ = 1,74 г/см3) снова выдвигает в последнее время магний как основу сплава на передний план.
В актуальном развитии сплавы Al-Li из-за своей легкости и хороших прочностных качеств пользуются все большим вниманием.
В мировом потреблении алюминия, %, наиболее интенсивно участвует упаковочная промышленность, особенно для банок с напитками:

В машиностроении наряду со сталью алюминий со своими сплавами стал одним из важнейших конструкционных материалов. Соответственно велико многообразие алюминиевых сплавов, которые соответствуют большому количеству необходимых требований. Рациональное разделение сплавов производится на литейные и деформируемые. Оба типа сплавов можно разделить на способные и не способные к дисперсионному твердению сплавы.
Алюминий не проявляет аллотропного преобразования, т.е. в противоположность к стали он не подвержен наклепу в результате фазового превращения., В качестве мер для повышения прочности этого материала могут применяться:
– наклеп;
– упрочнение легированием (упрочнение твердого раствора добавками и многофазностью);
– дисперсионное твердение (старение).

Так как стареющие алюминиевые сплавы, в частности типа AlCuMg, для достижения оптимальных характеристик требуют хорошего измельчения, то применяется термообработка для дисперсионного старения преимущественно у деформируемых сплавов; она пригодна также при высокопрочных качествах отливки для улучшения прочностных характеристик.
Литейные сплавы. К самым важным техническим литейным сплавам относятся сплавы Al-Si. Система Al-Si образует простую эвтектическую систему с эвтектической точкой при 11,7 % Si и 577 °C (рис. 9.4.29). Близкие к эвтектическим сплавы с содержанием от 11 до 13 % Si известны также как силуминовое литье. При медленном охлаждении (литье в песчаные формы) заэвтектического сплава с 13 % Si первично выделяющийся твердый раствор Si образует большие, угловатые, пластинчатые в шлифе, преимущественно игольчатые кристаллы. Эта неблагоприятная структура ведет к ярко выраженной хрупкости таких сплавов (рис. 9.4.30).
Нежелательной хрупкости можно избежать благодаря так называемому облагораживанию металлов. Путем добавки примерно 0,1 % Na при 720—780 °C в плавку неблагоприятно деформируемые кристаллы кремния очищаются, округляются и образуют тонкодиспергированную эвтектику (рис. 9.4.31). Эвтектическая температура снижается благодаря добавлению Na от 577 до 564 °C, причем эвтектическая концентрация сдвигается на 14 %. Заэвтектический сплав затвердевает, таким образом, доэвтектически, причем натрий, кроме того, вероятно, затормаживает диффузию.
При быстром охлаждении, которое существует в кокильном литье, достигается действие, подобное действию при облагораживании металлов. Здесь также сдвигается эвтектическая точка с помощью переохлаждения. Возникает очень чистая эвтектическая структура, так что при кокильном литье можно отказаться от облагораживания металлов натрием (см. рис. 9.4.29).

Предел прочности при растяжении необлагороженного литья в песчаные формы составляет от 100 до 120 Н/мм2. Он повышается благодаря облагораживанию металлов натрием до 240 Н/мм2 при показателях удлинения от 10 до 15 %. В кокильном литье прочность сплава составляет с 13 % Si до 260 Н/мм2.
Для поршневых сплавов повышается содержание Si и добавляется Cu. Маркированный поршневой сплав имеет 25 % Si и 5 % Cu.
Содержание меди в таких сплавах может увеличиваться до 14 %. Уже 1 % Cu повышает предел прочности при растяжении алюминия от 140 до 210 Н/мм2.
Особое значение имеет Cu при более высоком содержании для стареющих деформируемых алюминиевых сплавов. Для поршневых сплавов важна незначительная величина усадки — только 1,2%. Другим важным легирующим злементом для Al вообще, но особенно для литейных сплавов, является Mg (до 10 %). Такие сплавы отличаются хорошей устойчивостью против коррозии. Следует еще упомянуть легирующие элементы Mn (до 15 %), Zn (до 6 %), а также в небольших количествах Cr (до 0,4 %) и Ti (до 0,3 %).
Сплавы AlMn все шире применяются вместо чистого алюминия, так как эти сплавы объединяют очень хорошую устойчивость против коррозии с прочностью, более высокой по сравнению с чистым алюминием.
Деформируемые сплавы. Содержание легирующих составных частей, а также примесей в деформируемых сплавах в целом меньше, чем в литейных. В то время как литейные сплавы часто производятся с применением скрапа (вторичные сплавы), повышенные требования к деформируемым сплавам требуют преимущественно их выплавки из металлургического алюминия (первичные сплавы). Нестареющими деформируемыми сплавами являются AlMg-сплавы, у которых высокая твердость из-за легирования и прочность не уменьшаются от отжига и сварки. Принципиально диаграмма состояния AlMg-сплавов с уменьшающейся, растворимостью Mg в Al при снижении температуры имеет необходимые предпосылки к дисперсионному твердению (рис. 9.4.32). Однако здесь оказывается, что эти необходимые предпосылки сами по себе еще недостаточны, а что вид форма выделения при распаде играют существенную роль. К этой группе не способных к дисперсии сплавов относятся AlMn-сплавы с содержанием Mn до 2 %. Более высокого содержания Mn избегают из-за выделения повышенно хрупких А16Мn-кристаллов.

Возможность повышения прочности алюминиевых сплавов благодаря механизму старения металла значительно расширяет область применения этой группы материалов и придает обработке дисперсионным твердением такое же значение, каким обладает изменение твердости в результате фазового превращения у железных материалов, но особенно у стали. Важные подвергающиеся старению сплавы принадлежат к типу AlSi. Нестареющие AlMg-сплавы становятся стареющими вследствие добавок Cu (дюралюминий), Si и Zn.
Новое поколение высокопрочных Al-сплавов представляют Al—Li-силавы например Al—Li—Cu—Mg-сплавы, способные к дисперсии.
Литий является самым легким металлом вообще, его плотность составляет только 20 % плотности алюминия. По сравнению с обычными высокопрочным А1-сплавами Al—Li-сплавы примерно на 10 % легче. Вместе с более высокой (на 10 %) жесткостью можно достигнуть экономии массы на 15 % в конструкционной детали. У аэробусов такие сплавы конкурируют с углеродоволокнистыми комбинированными материалами. Более новые разработки благодаря сильному легированию сплавов типа Al—Li-материалов позволяют избежать незначительной вязкости и раннего образования трещин.
Механизм дисперсионного твердения, термообработка и достигаемое повышение прочности обсуждаются на примере группы AlCu-сплавов в разделе 13.3. Многократно сплавляемые подвергнутые дисперсионному твердению Al-сплавы достигают по прочности уровня высококачественных сталей.
Спеченный алюминиевый порошок (САП) (SAP). Изготовленные из Аl-порошка спеченные материалы обеспечивают набор требований, которые нельзя достигнуть с помощью обычных алюминиевых сплавов. Спеченный материал, состоящий из чистого Al-порошка, содержит от 6 до 14 % тонкого поверхностного слоя Al2O3, который размещается вокруг мельчайших зерен порошка. Порошок из сплава алюминия с Fe и Cr, а также 0,5 % Al2O3 превосходит по пределу термической текучести даже Ti в области от 300 до 500 °С. Этот материал применяется для лопастей компрессоров, теплообменников, а также в ядерных реакторах.
Самыми важными легирующими элементами для магния, который не пригоден в чистом виде как конструкционный материал, являются Al, Mn и/или Zn. Затвердевающий в гексагональной структуре Mg плохо деформируется в холодном состоянии и имеет неблагоприятную устойчивость против коррозии. Вместе с Zn посредством дальнейшего легирования от 0,5 до 0,7 % Zr и Ce достигаются беспористая отливка, измельчение зерна и благодаря этому улучшенная деформируемость. Благодаря Th повышается жаропрочность. Новые разработки связаны с литейными сплавами Mg-Y, которые имеют очень хорошую механическую твердость, около 290 Н/мм2, последняя снижается при 300 °C только до примерно 200 Н/мм2.
Различные магниевые сплавы известны под названием “электрон”. Магниевая отливка имеет благоприятное отношение Rm к р. По сравнению с серым литьем при применении магниевой отливки образуется экономия массы от 60 до 80 %, а в отличие от высококачественного алюминиевого литья всегда создается экономия от 15 до 20 %. Деформируемые сплавы, например, с 8 % Cd, 6 % Al, 2 % Zn, достигают при горячей или холодной прокатке прочности Rm≥4000 Н/мм2.
Из-за ограниченной устойчивости против коррозии и трудностей при обработке применение Mg-сплавов сегодня ограничивается менее сильнонагруженными деталями, такими как корпус и покрытие.
Из диаграммы состояния (рис. 9.4.33) можно было бы ожидать до содержания сплава 10% Al структуру из первичных δ-твердых растворов с γ-сегрегациями. Благодаря незначительной скорости диффузии появляются, однако, нарушения , равновесия, так что также сплавы с менее чём 12,6 % Al показывают (δ+γ-эвтектику вырожденной формы. Кристаллы Al2Mg3 образуют характерные пластины, которые создают структуру, подобную перлитному эвтектоиду у стали. Длительный отжиг вблизи линии растворимости приводит фазу Al2Mg3 к столбчатому выделению на плоскости базиса (0001) гексагональных δ-твердых растворов.
Титан является невзаимодействующим и используется как плакирующий материал в строительстве химических установок. Он отличается высокой устойчивостью против коррозии, окисляющих водных коррозионных сред. Высокая антикоррозийность образуется вследствие очень стабильного пассивированного оксидного слоя, который может быстро образоваться при слабых средствах окисления.
Титановые сплавы отличаются высокой прочностью, прежде всего высокой жаропрочностью. Титановые сплавы с соответствующей термообработкой достигают прочности от 1200 до 1400 Н/мм2. Титановые сплавы применяются до температуры 500 °С, а кратковременно даже до 1000 °C и, таким образом, заполняют пробел между Al-сплавами, которые применяются до примерно 150 °C, и жаропрочными сталями.
Очень благоприятное отношение прочности на разрыв к плотности Rm/p делает титановый сплав весьма подходящим для облегченных деталей конструкций, подвергающихся сильной нагрузке, как это можно наглядно видеть на примере шатуна для высокомощного двигателя.
Высокая цена, обусловленная дорогостоящим производством титана, противостоит широкому применению, которое имеется у Al-сплавов, но при легких конструкциях он часто выгоднее прочных и очень высокопрочных сталей.

Как и железо, титан также обладает аллотропным превращением. До температуры 882 °C титан обладает гексагональной структурой, выше нее — о.ц.к. β-структурой с уменьшенным на 0,55 % объемом. Как и для стали, легирующие элементы для титана можно разделить на те, которые стабилизируют; α-структуру, и те, которые расширяют область β-фазы. Гексагональная; α-структура обладает ограниченной деформируемостью, которая при высоких температурах благодаря склонности к восприятию Н, O и N уменьшается дальше. Модуль E сравнительно незначителен.
Наряду с Al важнейшими легирующими элементами в технических титановых сплавах являются V, Sn, Mo, Zr, Nb. и Cr. Al стабилизирует β-фазу и его содержание составляет у технических сплавов ниже 10 %. Структуры технических титановых сплавов имеются в виде α-, (α + β)- или β-структуры, иногда с интерметаллическими соединениями. Очень различающаяся растворимость легирующих элементов в β- и α-фазе создает благодаря превращению перенасыщенный a-твердый раствор, который можно упрочнить путем отжига.
Чрезвычайно благоприятное отношение Rm/p и очень высокая теплоемкость вызывают определенный интерес к бериллию для особых целей. Бериллий имеет в 1,5 раза большую жесткость, чем сталь. Тормозные диски из бериллий вследствие высокой теплоемкости при одинаковых условиях остаются существенно более холодными, чем диски из стали. Если при одинаковых опытных условиях температура диска из стали после двухминутной тормозной нагрузки достигает 560 °С, то диска из бериллия — лишь 390 °C.
Однако гексагональный бериллий имеет склонность к крупнокристаллическому затвердеванию. Он чрезвычайно хрупок и имеет структурно обусловленную четко выраженную анизотропию. В агломерированной чистой форме, однако, можно хорошо осуществлять горячую деформацию. В воздухоплавании b космоплавании применяются сплавы бериллия с примерно 25 % Al, Mg и Si.
В строительстве реакторов бериллий имеет значение из-за нейтронной проницаемости.
Бериллиевые окна применяются в рентгенотехнике и рентгеноаналитике, так как они поглощают лишь малое ионизирующее излучение. Как легирующий материал бериллий используется в медных материалах для изготовления высокообжигаемых литейных и деформируемых сплавов. Для материалов с бериллием, однако, установлены четкие границы применяемости из-за его вреда здоровью и окружающей среде. Бериллиевая пыль чрезвычайно ядовита и ведет к заболеваниям легких и кожным повреждениям. (Подобные границы необходимо соблюдать также при применении тяжелых металлов, в частности кадмия, обладающего очень большой антикоррозионной устойчивостью, но ядовитость его нельзя недооценивать.)
Самые прочные металлы в мире: топ-10

Можете ли вы представить, что произошло, если бы наши предки не обнаружили важные металлы, такие как серебро, золото, медь и железо? Наверное, мы бы до сих пор жили в хижинах, используя камень в качестве основного инструмента. Именно крепость металла сыграла важную роль в формировании нашего прошлого и теперь работают как основа, на которой мы строим будущее.
Некоторые из них очень мягкие и буквально тают в руках, как самый активный металл в мире. Другие — настолько твердые, что их невозможно согнуть, поцарапать или сломать без применения спецсредств.
А если вам интересно, какие металлы самые твердые и прочные в мире, мы ответим на этот вопрос, учитывая различные оценки относительной твердости материалов (шкала Мооса, метод Бринелля), а также такие параметры как:
- Модуль Юнга: учитывает эластичность элемента при растяжении, то есть способность объекта к сопротивлению при упругой деформации.
- Предел текучести: определяет максимальный предел прочности материала, после которого он начинает проявлять пластичное поведение.
- Предел прочности при растяжении: предельное механическое напряжение, после которого материал начинает разрушаться.
10. Тантал
 У этого металла сразу три достоинства: он прочный, плотный и очень устойчив к коррозии. Кроме того, этот элемент относится к группе тугоплавких металлов, таких как вольфрам. Чтобы расплавить тантал вам придется развести огонь температурой 3 017 °C.
У этого металла сразу три достоинства: он прочный, плотный и очень устойчив к коррозии. Кроме того, этот элемент относится к группе тугоплавких металлов, таких как вольфрам. Чтобы расплавить тантал вам придется развести огонь температурой 3 017 °C.
Тантал в основном используется в секторе электроники для производства долговечных, сверхмощных конденсаторов для телефонов, домашних компьютеров, камер и даже для электронных устройств в автомобилях.
9. Бериллий
 А вот к этому металлическому красавцу лучше не приближаться без средств защиты. Потому что бериллий высокотоксичен, и обладает канцерогенным и аллергическим действием. Если вдыхать воздух, содержащий пыль или пары бериллия, то возникнет заболевание бериллиоз, поражающее легкие.
А вот к этому металлическому красавцу лучше не приближаться без средств защиты. Потому что бериллий высокотоксичен, и обладает канцерогенным и аллергическим действием. Если вдыхать воздух, содержащий пыль или пары бериллия, то возникнет заболевание бериллиоз, поражающее легкие.
Однако бериллий несет не только вред, но и благо. Например, добавьте всего 0,5 % бериллия в сталь и получите пружины, которые будут упругими даже если довести их до температуры красного каления. Они выдерживают миллиарды циклов нагрузки.
Бериллий применяют в аэрокосмической промышленности для создания тепловых экранов и систем наведения, для создания огнеупорных материалов. И даже вакуумная труба Большого Адронного Коллайдера сделана из бериллия.
8. Уран
 Это естественное радиоактивное вещество очень широко распространено в земной коре, но сконцентрировано в определенных твердых скальных образованиях.
Это естественное радиоактивное вещество очень широко распространено в земной коре, но сконцентрировано в определенных твердых скальных образованиях.
Один из самых твердых металлов в мире имеет два коммерчески значимых применения — ядерное оружие и ядерные реакторы. Таким образом, конечной продукцией урановой промышленности являются бомбы и радиоактивные отходы.
7. Железо и сталь
 Как чистое вещество железо не такое твердое по сравнению с другими участниками рейтинга. Но из-за минимальных затрат на добычу оно часто комбинируется с другими элементами для производства стали.
Как чистое вещество железо не такое твердое по сравнению с другими участниками рейтинга. Но из-за минимальных затрат на добычу оно часто комбинируется с другими элементами для производства стали.
Сталь — это очень прочный сплав из железа и других элементов, таких как углерод. Это наиболее часто используемый материал в строительстве, машиностроении и других отраслях промышленности. И даже если вы не имеете к ним никакого отношения, то все равно используете сталь каждый раз, когда режете продукты ножом (если он, конечно, не керамический).
6. Титан
 Титан — это практически синоним прочности. Он обладает впечатляющей удельной прочностью (30-35 км), что почти вдвое выше, чем аналогичная характеристика легированных сталей.
Титан — это практически синоним прочности. Он обладает впечатляющей удельной прочностью (30-35 км), что почти вдвое выше, чем аналогичная характеристика легированных сталей.
Будучи тугоплавким металлом, титан обладает высокой устойчивостью к нагреву и истиранию, поэтому является одним из самых популярным сплавов. Например, он может быть легирован железом и углеродом.
Если вам нужна очень твердая и при этом очень легкая конструкция, то лучше чем титан металла не найти. Это делает его выбором номер один для создания различных деталей в авиа- и ракетостроении и судостроении.
5. Рений
 Это очень редкий и дорогой металл, который хотя и встречается в природе в чистом виде, обычно идет «довеском»-примесью к молибдениту.
Это очень редкий и дорогой металл, который хотя и встречается в природе в чистом виде, обычно идет «довеском»-примесью к молибдениту.
Если бы костюм Железного человека был сделан из рения, он мог бы выдержать температуру в 2000 ° C без потери прочности. О том, что стало бы с самим Железным человеком внутри костюма после такого «фаер-шоу» мы умолчим.
Россия — третья страна в мире по природным запасам рения. Этот металл используется в нефтехимической промышленности, электронике и электротехнике, а также для создания двигателей самолетов и ракет.
4. Хром
 По шкале Мооса, которая измеряет устойчивость химических элементов к царапинам, хром находится в пятерке лучших, уступая лишь бору, алмазу и вольфраму.
По шкале Мооса, которая измеряет устойчивость химических элементов к царапинам, хром находится в пятерке лучших, уступая лишь бору, алмазу и вольфраму.
Хром ценится за высокую коррозионную стойкость и твердость. С ним легче обращаться, чем с металлами платиновой группы, к тому же он более распространен, поэтому хром является популярным элементом, используемым в сплавах, таких, как нержавеющая сталь.
А еще один из прочнейших металлов на Земле используется при создании диетических добавок. Конечно, вы будете принимать внутрь не чистый хром, а его пищевое соединение с другими веществами (например, пиколинат хрома).
3. Иридий
 Как и его «собрат» осмий, иридий относится к металлам платиновой группы, и по внешнему виду напоминает платину. Он очень твердый и тугоплавкий. Чтобы расплавить иридий, вам придется развести костер температурой выше 2000 °C.
Как и его «собрат» осмий, иридий относится к металлам платиновой группы, и по внешнему виду напоминает платину. Он очень твердый и тугоплавкий. Чтобы расплавить иридий, вам придется развести костер температурой выше 2000 °C.
Иридий считается одним из самых тяжелых металлов на Земле, а также одним из самых устойчивых к коррозии элементов.
2. Осмий
 Этот «крепкий орешек» в мире металлов относится к платиновой группе и обладает высокой плотностью. Фактически это самый плотный природный элемент на Земле (22,61 г/см3). По этой же причине осмий не плавится до 3033 ° C.
Этот «крепкий орешек» в мире металлов относится к платиновой группе и обладает высокой плотностью. Фактически это самый плотный природный элемент на Земле (22,61 г/см3). По этой же причине осмий не плавится до 3033 ° C.
Когда он легирован другими металлами платиновой группы (такими как иридий, платина и палладий), он может использоваться во многих различных областях, где необходимы твердость и долговечность. Например, для создания емкостей для хранения ядерных отходов.
1. Вольфрам
 Самый прочный металл, который только есть в природе. Этот редкий химический элемент также самый тугоплавкий из металлов (3422 ° C).
Самый прочный металл, который только есть в природе. Этот редкий химический элемент также самый тугоплавкий из металлов (3422 ° C).
Впервые он был обнаружен в форме кислоты (триоксида вольфрама) в 1781 году шведским химиком Карлом Шееле. Дальнейшие исследования привели двух испанских ученых — Хуана Хосе и Фаусто д’Эльхуяра — к открытию кислоты из минерала вольфрамита, из которого они впоследствии изолировали вольфрам с помощью древесного угля.
Помимо широкого применения в лампах накаливания, способность вольфрама работать в условиях сильной жары делает его одним из наиболее привлекательных элементов для оружейной промышленности. Во время Второй мировой войны этот металл сыграл важную роль в инициировании экономических и политических отношений между европейскими странами.
 Сплавы представляют собой комбинации металлов, и основной причиной их создания является получение более прочного материала. Наиболее важным сплавом является сталь, которая представляет собой комбинацию железа и углерода.
Сплавы представляют собой комбинации металлов, и основной причиной их создания является получение более прочного материала. Наиболее важным сплавом является сталь, которая представляет собой комбинацию железа и углерода.
Чем выше прочность сплава — тем лучше. И обычная сталь тут не является «чемпионом». Особенно перспективными представляются металлургам сплавы на основе ванадиевой стали: несколько компаний выпускают варианты с пределом прочности до 5205 МПа.
А самым прочным и твердым из биосовместимых материалов на данный момент является сплав титана с золотом β-Ti3Au.
Что легче вода или медь
Когда заходит речь о легком металле, называют обычно алюминий. Однако он занимает далеко не первое место в ряду легких металлов: существует несколько металлов, которые легче его. Ниже приведен их перечень с указанием удельного веса (плотности) каждого:
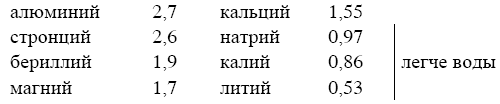
Рекорд легкости побивает, как видим, литий[6] – металл, который легче многих пород дерева и плавает в керосине, погружаясь до половины. Он в сорок раз легче самого тяжелого металла – осмия.
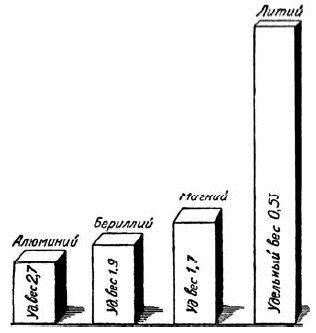
Рис. 58. Призмы равного веса из некоторых легких металлов
Из сплавов, применяемых в современной промышленности, выделяются своей легкостью следующие (французские инженеры, занимающие одно из первых мест в производстве высококачественных легких сплавов, называют «легкими» все сплавы с плотностью меньше 3):
1) дюралюминий и кольчугалюминий С сплавы алюминия с небольшим количеством меди и магния; при плотности 2,6 они втрое легче железа, будучи прочнее его в полтора раза;
2) дюрбериллий – сплав бериллия с медью и никелем; он легче дюралюминия на 25 % и прочнее на 40 %;
3) электрон (не смешивать с элементарным количеством отрицательного электричества)[7] – сплав магния, алюминия и др.; почти не уступая в прочности дюралюминию, электрон легче его на 30 % (плотность 1,84).
Мы не останавливаемся здесь на ряде таких легких алюминиевых сплавов, как лоталь, силумин, склерон, конструкталь, магналий (предшественник электрона), употребляемых на Западе.
Данный текст является ознакомительным фрагментом.
Медная посуда: польза и вред для организма человека – самая подробная информация простыми словами

Я хочу рассказать о том, почему используется медная посуда, в чем ее польза и вред для организма человека. Вы узнаете об удивительно полезных свойствах меди для нашего тела; определитесь, стоит ли покупать кухонную утварь из этого металла. Научитесь правильно ухаживать за ней. В статье есть информация, что такое медная вода, как ее приготовить и использовать.
Помните, как пелось в советской песне: «И пил солдат из медной кружки…». А почему, собственно, солдат пил именно из медной кружки? Какие качества имеет кухонная утварь из этого металла? Многие, наверное, не задумывались об этом.
А напрасно. Ведь медная посуда не только шикарно и богато смотрится на кухне, но и обладает очень полезными для человеческого организма свойствами. И правильное ее использование поможет решить многие проблемы со здоровьем.
Для чего нашему телу нужна медь
Трудно переоценить значение микроэлемента медь(Сu) для организма. Она принимает участие в работе практически всех систем и органов:
- участвует в создании коллагена, который необходим для подержания в тонусе кожи и связок
- укрепляет ткань костей, защищая от остеопороза
- улучшает эластичность и прочность стенок сосудов нашей кровеносной системы
- поддерживает в хорошем состоянии ногти и волосы
- участвует в кроветворении

- обеспечения связи между нервными клетками
- поддержания иммунитета
- нормализации работы щитовидной железы
- обеспечения нормальной работы опорно-двигательного аппарата.
В норме, человек с пищей получает достаточное количество меди. Но в некоторых случаях придется принимать этот микроэлемент дополнительно: при проблемах с ЖКТ, курильщикам, при частом употреблении алкоголя, при обширных ожогах и переломах. В этих случаях требуется дополнительное употребление препаратов меди. Назначить нужное средство и дозировку может только врач.
Поэтому при обнаружении у себя симптомов нехватки этого микроэлемента обращайтесь к специалисту. Вот некоторые признаки недостатка меди:
- Выпадение волос
- ранняя седина
- побледнение кожных покровов
- анемия
- головные боли, головокружение
- быстрая утомляемость
- боли в суставах
- беспричинное исхудание
- депрессия
Не факт, что один признак говорит о дефиците, но, если их несколько, то это должно с подвигнуть вас на посещение специалиста. На всякий пожарный.
Переизбыток меди бывает крайне редко. Это может случится при: отравлении парами на производстве, нарушении процесса обмена микроэлементов в организме, при заболевании (астма, ревматизм, лейкоз и др.), передозировке медьсодержащих препаратов.
- тошнота, рвота, диарея
- боль в животе
- привкус металла во рту
- головная боль
- жажда
- нарушения сна

В каких продуктах есть Cu
При правильном питании человек получает достаточное количество меди с пищей. Плюс ко всему этот микроэлемент присутствует в водопроводной воде. Но вегетарианцам и веганам, если их рацион недостаточно сбалансирован, можно обратить внимание на проростки зерен пшеницы, спаржу, сою и хлеб из ржаной муки. Впрочем, многие из них подходят к своему рациону вдумчиво.
Почерпнуть запасы купрума можно из:
- морепродуктов (печень трески, кальмары, креветки)
- печени животных (говяжья, свиная)
- темного шоколада
- орехов (арахис, фундук, грецкий орех)
- крупы (чечевица, гречка, рис, овсянка)
- бобовых (горох, фасоль)
- макарон
- семечек (кунжут, тыквенные, подсолнечные)
- овощей (шпинат, капуста, баклажаны)
- зелени (базилик, петрушка, укроп, кинза)
И это далеко не полный список продуктов с содержанием меди. Не стоит забывать о кисломолочке, свежем мясе, яйцах, фруктах и ягодах.
Почему всё-таки солдат пил из медной кружки?
Благотворное воздействие меди известно давным-давно. Древние воины, вооруженные медными доспехами, меньше уставали, а раны, полученные в бою, гораздо быстрее затягивались, потому, что медь ускоряла заживление. В средневековье при эпидемии чумы, люди, связанные с медным производством, практически не болели.
 На Востоке хранили воду в медных кувшинах. От этого она долго сохранялась, не портилась. Это все потому, что медь обладает противобактериальным и противогрибковым действием. Для примера: вода в медном сосуде очищается от кишечной палочки за 4 часа.
На Востоке хранили воду в медных кувшинах. От этого она долго сохранялась, не портилась. Это все потому, что медь обладает противобактериальным и противогрибковым действием. Для примера: вода в медном сосуде очищается от кишечной палочки за 4 часа.
Вот поэтому во многих армиях мира применялась посуда из меди. И солдатская кружка в том числе. В походных условиях в то время трудно было соблюсти должным образом гигиену. А медь справлялась с этим как нельзя лучше.
Медная посуда: польза и вред для организма человека
Итак, главным положительным качеством утвари из Cu будут ее антисептические свойства по отношению к бактериям и грибкам. Употребляя медную воду (о ней речь пойдет ниже) можно очистить ЖКТ от подобной «нечисти».
Высокая теплопроводность этого металла очень помогает сохранить большое количество полезных веществ. Ведь кастрюля или сковородка прогреется быстро и равномерно, и пища приготовится в разы быстрее. А полезности в продукте не успеют обнулиться.
При приготовлении, еда в такой посуде пропитывается микрочастицами меди и приобретают своеобразный вкус и аромат. Готовя в сковородах и кастрюлях из другого металла, добиться такого аромата увы, не получится.
Недостатки медной утвари
Но при неумелом использовании медная утварь может причинить вред:
- от соприкосновения с медной поверхностью разрушается аскорбиновая кислота (витамин С), так что фреши из такой посуды пить не стоит
- нельзя хранить сырые продукты в емкостях из Сu, так как разрушаются кислоты и витамины, которых много в ягодах, фруктах и овощах. Так же происходит окисление полиненасыщенных жирных кислот. Это может привести к серьезным заболеваниям при употреблении этих продуктов. Да и вообще в этих сосудах пищу лучше не оставлять надолго
- поверхность медной посуды окисляется во влажной среде, появляется характерный зеленоватый налет. От этой оксидной пленки (патины) нужно обязательно избавляться, своевременно очищая стенки.
Для того, чтобы уменьшить возможное негативное воздействие на пищу, изнутри поверхность посуды иногда покрывают тонким слоем другого металла. Чаще всего это олово или нержавейка.

Если вам захочется приобрести медную утварь, обратите внимание на вес. Медь достаточно тяжелый металл, и поэтому если приобретаемое изделие по весу сопоставимо с алюминиевым, то значит вам пытаются продать алюминиевую посудинку с тонким напылением меди. То есть за дорого хотят продать подделку. Не позволяйте себя обмануть!
Как ухаживать за медной посудой
Как бы ни была красива кастрюля или какой другой кухонный предмет из меди, но их поверхность быстро покрывается налетом, и за ней нужно ухаживать. Бережно и нежно. Главное бережно, но и нежно тоже.
- А если серьезно, медь металл мягкий и посуду из него можно легко поцарапать. Поэтому помешиваем пищу деревянной или пластиковой лопаточкой.
- Не оставляем пустую посуду на плите. От этого она может прогореть.
- После мытья утварь обязательно вытираем насухо во избежание образования опасной патины.
- Избегаем ударов и падений. Иначе не избежать некрасивых вмятин и вогнутостей.
- Мыть такую посуду лучше всего вручную, без абразивных паст и щеток. И никаких посудомоечных машин. Химические средства очистки с хлором тоже под запретом.
Сейчас в продаже великое множество средств для чистки и ухода за медью. Но стоят они очень недешево. Если вам это подходит – не вопрос, они в самом деле эффективные. Большинство из них.
Но если тратиться лишний раз не хочется, то существуют альтернативно-народные способы ухода, не менее действенные. Мало того, затрат они потребуют копеечных. Зато в начищенные поверхности можно будет смотреться как в зеркало.
 Все методы я проверял сам, на своей любимой кружке и не менее любимом стакане. Так что имею право рекомендовать вам.
Все методы я проверял сам, на своей любимой кружке и не менее любимом стакане. Так что имею право рекомендовать вам.
5 вариантов чистки медной поверхности
Способ 1: в моем рейтинге он занимает первое место. Берем лимон, разрезаем его пополам. Обмакиваем эту половинку в мелкую соль, натираем стенку к примеру кастрюли, и оставляем на время. Если поверхность сильно окислена, то делаем это несколько раз. Должен заметить, что тереть нужно не сильно надавливая. Через некоторое время (я оставлял на 30 секунд) смываем все водой и вытираем насухо.
Способ 2: Смешиваем 1 столовую ложку муки, 0,5 ложки соли. Добавляем 2 ст. л. уксуса. Все перемешиваем и полученной массой покрываем очищаемую поверхность. Натираем этой массой. Смываем, вытираем досуха.
Способ 3: 2-3 столовых ложки соли добавить в стакан уксуса. Пока соль не растворилась полностью, опускаем медный предмет и натираем его солью. Концовка та же: вытираем и сушим.
Способ 4: Выдавливаем обычный кетчуп и размазываем по поверхности очищаемого предмета. Оставляем на 15-20 минут. Для ускорения процесса стенки можно натирать этой массой. После промываем водой и протираем сухой тканью.
Способ 5: менее действенный, но все равно рабочий. В 100 мл. воды растворить 10 г лимонной кислоты, раствор подогреть и опустить туда медяшку. Держать некоторое время в жидкости, ориентируясь по внешнему виду. При обретении поверхности металла удовлетворительного вида вынимаем и вытираем. Подойдет скорее для небольших предметов.
Неужели это живая вода?
Я уже говорил, что вода, выстоянная в медном сосуде, обладает антибактериальными и противогрибковыми свойствами. Но это далеко не все полезности и ништячки от ее употребления. При правильном применении эта водица будет способствовать регулированию в работе большинства систем организма:
- Благотворно влияет на работу сердца и сосудов. Медь помогает в стабилизации кровяного давления, частоты пульса, борется с образованием холестериновых бляшек;
- Стимулирует работу мозга и всей нервной системы;
- Стимулирует перистальтику кишечника, уничтожает патогенную микрофлору в ЖКТ;
- Нормализует работу щитовидной железы;
- Нормализует работу печени и почек, способствует их очищению;
- Способствует заживлению ран;
- Способствует выработке эластина и коллагена, тем самым поддерживает кости и сухожилия в «рабочем» состоянии;
- Помогает при воспалении суставов, оказывая противовоспалительное и болеутоляющее действие;
- Борется с анемией, улучшая усвоение железа организмом;
- Способствует обновлению тканей организма, замедляя старение;
- Защищает от ранней седины.

Вот такая она замечательная эта медная вода. А приготовить ее не трудно. Вечером наливаете в медный сосуд, чем-нибудь накрываете и оставляете на ночь. Поутру медная вода готова. Великая наука древности Аюрведа рекомендует принимать с утра 2 стакана этой жидкости. Больше не стоит.
По качеству металла, из которого изготовлена посуда. Это должна быть максимально чистая медь, например, марки М1. Количество Cu в ней 99,9%. Такую воду можно не только пить, но и умываться, промывать раны, массировать больные суставы.
Нельзя хранить приготовленную жидкость в холодильнике, она должна быть комнатной температуры. Не стоит готовить на ней еду. Постоянно следите за емкостью для настаивания, регулярно очищайте стенки от потемнений и патины.
Заключение
Вот такая она, эта медная посуда, такие от нее польза и вред для организма человека. Я постарался дать вам полную информацию. Сам настаиваю воду в медной кружке и с утреца выпиваю 1-2 стакана (кружка у меня большая). Болею очень редко. Может, медная вода помогает?
Если понравилась статья, то не поленитесь, поделитесь с друзьями. Да и сами почаще захаживайте в гости на мой сайт. Много интересного найдете для себя.
Источник https://wotakks.ru/metally-drugoe/kakoj-metall-samyj-legkoplavkij.html
Источник https://elton-zoloto.ru/metally-i-splavy/kakoj-samyj-legkij-metall.html
Источник https://ollimpia.ru/chto-legche-voda-ili-med/


